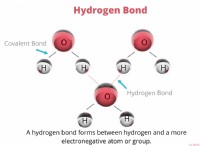
1。価電子と安定性:
* 原子は安定性のために努力します: 原子は、電子の完全な外側の殻(貴族のような)を持っている場合、最も安定しています。
* 価電子が鍵です: 価電子は、原子の最も外側の殻の電子です。これらは化学結合に関与するものです。
2。 イオン結合 - 電子の伝達:
* 金属と非金属: イオン結合は通常、金属(電子を失う傾向がある)と非金属(電子を獲得する傾向がある)の間で発生します。
* 電子移動: 金属原子が非金属原子と相互作用すると、金属原子はその原子価電子を非金属原子に *寄付 *します。この転送は次のように作成します。
* カチオン: 電子を失った金属原子は、正に帯電したイオン(陽イオン)になります。
* アニオン: 電子を獲得した非金属原子は、負に帯電したイオン(アニオン)になります。
3。 静電引力は結合を保持します:
* 反対の料金を引き付ける: 陽イオンと陰イオンの反対の電荷は、イオン結合でそれらをまとめる強力な静電引力を作り出します。
例:塩化ナトリウム(NaCl)
* ナトリウム(Na): 1つの価電子があります。
* 塩素(cl): 7つの価電子があります。
* 転送: ナトリウム *は、その原子価電子を塩素に失い、ナイオンになります。 塩素 *を獲得 *この電子を獲得し、クロイオンになります。
* ボンド: 反対に帯電したナシオンとcl⁻イオンは互いに引き付けられ、イオン化合物の化合物ナトリウム塩化ナトリウム(NaCl)、またはテーブル塩が形成されます。
要約:
価電子は、イオン結合の背後にある駆動力です。それらはある原子から別の原子に移され、その結果、反対に帯電したイオンが形成されます。これらのイオンは、静電力を通して互いに引き付けられ、強いイオン結合が生じます。