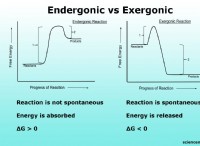
図を理解する
* 核: 図の中心は、陽子と中性子を含む核を表します。
* 陽子: プロトンの数は要素を定義します。コバルトには27個のプロトンがあり、(+)シンボルで表されます。
* 中性子: 中性子の数は異なる場合があり、同位体が生成されます。 Cobalt-59は最も一般的な同位体であるため、32個の中性子を使用します(27個のプロトン + 32個の中性子=59)。中性子は(n)シンボルで表されます。
* 電子: 電子は、核の周りの円で表されるシェルと呼ばれる特定のエネルギーレベルを占めます。
*シェル1(核に最も近い)には、最大2つの電子が保持されます。
*シェル2には最大8電子が保持されます。
*シェル3には最大18個の電子が保持されます。
図を描く
1。核を描く: 核を表す紙の中央にある大きな円。内部では、プロトンの27(+)シンボルを書き込み、中性子に32(n)シンボルを書きます。
2。シェルを描く: 最初の3つの電子シェルを表す3つの円(またはリング)を核の周りに描きます。
3。電子を配置:
* シェル1: 最初のシェルに2つの電子(( - )シンボルで表されます)を満たします。
* シェル2: 2番目のシェルに8つの電子を満たします。
* シェル3: 3番目のシェルに17個の電子を満たします。
重要なメモ:
* Bohr-rutherford図は、原子の単純化された表現であり、電子軌道の複雑な3D形状を示していません。
*その同位体の質量数から原子数(27)を減算することにより、コバルトの特定の同位体の中性子の数を見つけることができます。
図の視覚化に役立つ場合はお知らせください!