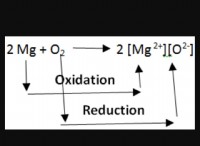
* 反応性を定義する原子価電子: 価電子は、原子の最も外側のエネルギーレベルの電子です。それらは化学的結合に関与し、元素の反応性を決定します。
* 安定したオクテット/デュエット: 原子は、通常は完全な外側シェルを持つことにより、安定した電子構成を実現するよう努めています。ほとんどの原子の場合、これは8つの価電子を持つことを意味します(オクテットルール)。水素やヘリウムなどの非常に小さな原子の場合、2つの価電子(デュエットルール)で安定性に十分です。
* 例外: Octetルールは有用なガイドラインですが、特に遷移金属にはいくつかの例外があります。ただし、これらの場合でも、原子は、常にオクテットルールに厳密に従っているわけではない場合でも、依然として価電子を備えています。
要約: 最も外側のエネルギーレベルには、原子が安定して化学反応に関与するためのいくつかの電子が含まれている必要があるため、原子またはイオンがゼロ価電子を持つことは不可能です。