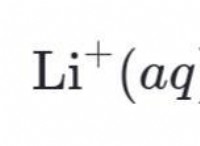イオン化エネルギーに影響する要因
* 原子半径: より大きな原子はイオン化エネルギーが低い。これは、最も外側の電子が核から遠く、魅力が少ないためです。引力が弱いほど、電子を除去しやすくなります。
* 核電荷(陽子の数): より高い核電荷(より多くの陽子)は、核と電子の間のより強い魅力につながります。これにより、電子を除去するのが難しくなり、イオン化エネルギーが高くなります。
* シールド効果: 内側のエネルギーレベルの電子(核に近い)は、核の完全な正電荷から外側の電子を保護します。 シールドが多いほど、核と最も外側の電子の間の魅力が弱くなり、除去が容易になります。
* 電子構成: より高いエネルギーレベルの電子は、核から遠く、密着性が低く、イオン化エネルギーが低くなります。 たとえば、S軌道の原子価電子は、P軌道の原子価電子よりも低いイオン化エネルギーを持っています(エネルギーレベルの違いのため)。
* 浸透効果: この効果は、他の電子よりも核に近い「浸透」する特定の軌道中の電子の能力を指します。 より多くの浸透を持つ電子は、より強い核引力を経験し、より高いイオン化エネルギーをもたらします。
例:
* アルカリ金属(グループ1): アルカリ金属は、それぞれの期間で最も低いイオン化エネルギーを持っています。これは、核と最も外側の電子の間の大きな原子サイズ、単一価電子、および弱い引力によるものです。
* ハロゲン(グループ17): ハロゲンは、イオン化エネルギーが比較的高い。 それらは小さな原子サイズと、核と7つの原子価電子の間に強い魅力を持っています。
* nobleガス(グループ18): 貴族は、電子の構成が非常に安定しているため、非常に高いイオン化エネルギーを持っています。 電子を除去すると、この安定性が破壊されます。
キーテイクアウト:
*イオン化エネルギーを低くすると、電子を除去する方が簡単です。
*原子サイズ、核電荷、シールド、電子の構成などの要因は、イオン化エネルギーの決定に重要な役割を果たします。
*周期的な傾向は、これらの要因が周期表の要素の配置にどのように関連するかを理解するのに役立ちます。