1。安定した構成の達成:
* オクテットルール: 原子は、多くの場合、完全な外側シェル(8電子)を備えた安定した電子構成を実現するよう努めています。
* 静電引力: 外側のシェルに電子が少ない原子は、より多くの電子を持つ原子に引き付けられ、独自の外側のシェルを埋めようとします。この魅力は、電子の伝達を促進します。
* 電気陰性度: 原子が電子を引き付ける傾向は、電気陰性度と呼ばれます。電気陰性度の高い元素は電子を獲得する傾向がありますが、電気陰性度が低い要素は電子を失う傾向があります。
2。エネルギーレベルの違い:
* イオン化エネルギー: 原子から電子を除去するために必要なエネルギー。イオン化エネルギーが低い要素は、電子を容易に失います。
* 電子親和性: 原子が電子を獲得するとエネルギーが変化します。電子親和性が高い元素は、容易に電子を獲得します。
3。化学結合の形成:
* イオン結合: イオン結合では、1つの原子は完全に電子(陽イオンを形成)を失い、もう1つは電子(アニオンを形成する)を獲得します。反対の電荷は互いに引き付けられ、強いイオン結合を形成します。
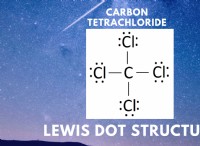
* 共有結合: 共有結合では、安定した構成を実現するために、原子間で電子が共有されます。電子は完全には伝達されていませんが、一方の原子よりも一方の原子よりも多くの時間を費やして、部分電荷の違いを生み出します。
4。酸化還元反応:
* 酸化: 電子の損失。
* 削減: 電子の増加。
* 酸化還元反応: 反応物間の電子の伝達を含む化学反応。
例:
* 塩化ナトリウム(NaCl): ナトリウム(Na)は電子を失い、Na+になりますが、塩素(Cl)は電子を獲得してCl-になります。反対に帯電したイオンは、イオン結合を形成します。
* マグネシウムの燃焼(mg): マグネシウムは酸素(O2)と反応して酸化マグネシウム(MGO)を形成します。マグネシウムは電子を失い(酸化)、酸素を酸素にし、電子を獲得します(減少します)。
要約: 電子移動は、安定性、原子間のエネルギーの違い、および化学結合の形成の探求によって駆動される化学の基本的なプロセスです。これは、物質の行動を形作り、私たちの周りで発生する反応に影響を与える重要な要因です。