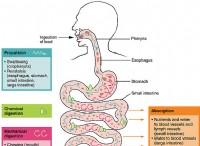
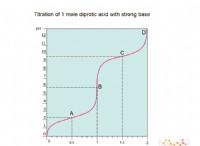
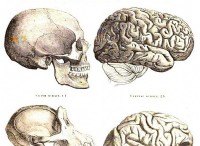
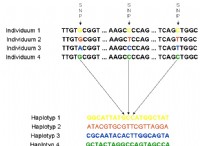
1。原子安定性
* 定義: 原子安定性とは、変化または分解に抵抗する原子の全体的な傾向を指します。次のような要因の影響を受けています。
* 電子構成: 原子は、安定性を提供する完全な外側の電子シェルを努力します。
* 化学結合: 原子は他の原子と結合して、より安定した電子構成を実現します。
* イオン化: 原子は電子を獲得または失い、イオンになる可能性があり、時には安定性を高めます。
* 例: ヘリウム(HE)、ネオン(NE)、アルゴン(AR)のような貴族は、外側の電子シェルがすでにいっぱいであるため、非常に安定しています。
2。核安定性
* 定義: 核の安定性は、原子の核、特に陽子と中性子のバランスの安定性に焦点を当てています。
* 中性子対プロトン比: 核安定性には、一般に中性子と陽子の特定の比率が必要です。
* 結合エネルギー: 核内で陽子と中性子を一緒に保持するエネルギー。 高い結合エネルギーは、安定した核を示します。
* 放射能: 不安定な核は、より安定した構成を実現するために、放射性プロセス(アルファ、ベータ、ガンマ崩壊)を介して減衰します。
* 例: 炭素-12(⁶c)は、6つのプロトンと6つの中性子を備えた安定した同位体です。ただし、炭素-14(¹⁴c)は放射性であり、6つのプロトンと8つの中性子を抱えています。より安定した同位体になるために時間とともに減衰します。
重要な違い
* フォーカス: 原子安定性は、その電子構成、化学結合、イオン化など、原子全体を扱います。核安定性は、特に核、陽子と中性子のバランスに焦点を当てています。
* プロセス: 原子安定性は、化学反応と相互作用によって達成されます。核の安定性は、核プロセスを通じて達成され、時には放射性崩壊が含まれます。
要約:
* 原子安定性 電子の全体的な配置と結合を形成する能力についてです。
* 核安定性 核内の陽子と中性子のバランスについてです。