コア コンセプト
このチュートリアルでは、一塩基酸、二塩基酸、三塩基酸、および多塩基酸の定義を学びます。また、異なる酸間、多塩基酸内のプロトン間の酸性度の傾向、および多塩基酸の滴定曲線についても学びます。
他の記事で取り上げるトピック
- 酸塩基化学
- 強酸/強塩基
- 弱酸/弱塩基
- 酸と塩基の性質
- 滴定曲線
語彙
プロトン :ここでいうプロトンとは、水素原子から電子が取り除かれたもの (水素イオン) のことです。 H とも表記されます。
ブレンステッド-ロウリー酸 :プロトン (H) ドナー。
ブレンステッド ローリー基地 :プロトン (H) 受容体。
カア :酸脱プロトン化反応の平衡定数 (順方向)。
モノプロトン酸とは?
一般的に見られるほとんどの酸はモノプロトンです。つまり、1 つのプロトンしか放棄できません。モノプロトン酸の例:
- HCl (塩酸)
- CH3 COOH(酢酸)
- HNO3 (硝酸)
塩酸と硝酸の式には水素が 1 つしかなく、水素は酸性 (陽子として放出されることを意味します) であることに注意してください。ただし、酢酸には酸性ではない水素があります。酸にはしばしば非酸性水素があることに注意することが重要です。
多塩基酸とは?
多塩基酸は、複数のプロトンを供与できる任意のブレンステッド-ローリー酸です。上記の例ではプロトンを 1 つしか放出できませんが、多くの酸は複数の酸性水素を持っています。以下にいくつかの例を示します:
- H2 SO4 (硫酸)
- H3 PO4 (リン酸)
- C10 H16 N2 O8 (エチレンジアミン四酢酸、略して EDTA)
これらの酸はそれぞれ、複数の酸性プロトンを持っています。硫酸は 2 つなので、di と呼ばれます。 プロトン酸。リン酸は 3 つあるので、tri と呼ばれます。 プロトン酸。 EDTA には 4 つの酸性プロトンがあります。つまり、技術的には四プロトン酸と呼ばれますが、実際には、プロトンが 3 つを超える酸は単にポリプロトンと呼ばれます。理論的には、多塩基酸が持つことができる酸性プロトンの数に制限はありません。
ポリプロチン酸はどのように機能しますか?
酸がプロトンを放棄すると、共役塩基と呼ばれるものが形成されることを思い出してください。モノプロトン酸の場合、共役塩基は酸性プロトンを持たず、(当然のことながら) 塩基としてのみ機能します。ただし、多塩基酸の場合、元の酸の共役塩基は酸性プロトンを持っています。つまり、共役塩基も酸です。 .いくつかの例を見てみましょう。
HCl ⇌ Cl + H
上記の平衡では、強力なモノプロトン酸である塩酸が酸性水素を放出します。これにより、共役塩基である塩化物とプロトンが形成されます。酸性プロトンがなくなるため、それ以上の反応はありません。
H3 PO4 ⇌H2 PO4 + HP
上記の平衡は、リン酸からの最初の酸性プロトンの損失を示しています。この陽子が失われた後も、共役塩基にはまだ酸性の陽子が残っていることに注意してください。 .これは、共役塩基が別の平衡で酸として作用できることを意味します:
H2 PO4 ⇌ HPO4 + HP
また、(2 番目の) 共役塩基にはまだ酸性プロトンが残っています。したがって、発生する可能性のある最後の脱プロトンが 1 つあります:
HPO4 ⇌ PO4 + HP
元の分子であるリン酸がトリプロトンであるため、3 つの脱プロトンが発生しました。
Ka の三塩基酸 最高値を持っていますか?
多塩基酸の酸性度は単純です:各プロトンは最後のプロトンよりも酸性度が低い .これは、K
H3 PO4 ⇌H2 PO4 + H K
H2 PO4 ⇌ HPO4 + H K
HPO4 ⇌ PO4 + H K
1 回目と 2 回目の脱プロトンの間に、K
この表は、多くの多塩基酸を含むさまざまな酸を示しています。自由にスキャンしてみてください。すべてのポリプロチン酸がより大きな K
二塩基酸は一塩基酸より強いですか?
必ずしも。分子内の酸性水素の数は、それらの水素の酸性度 (または具体的には、最も酸性の水素の酸性度) とは何の関係もありません。塩酸 (モノプロトン) はリン酸 (トリプロトン) よりもはるかに強く、硫酸 (ジプロトン) はフッ化水素酸 (モノプロトン) よりもはるかに強力です。基本的に、水素の数は関係ありません。
ポリプロチン酸滴定曲線
ポリプロトン酸が最初のプロトンを失うと、新しい弱酸を形成することを以前に学びました.これは、酸/塩基化学においておそらく最も一般的で重要な技術である滴定を行う際に覚えておくことが重要です。新しく形成された酸 (元の酸の共役塩基) はプロトンを失う可能性があるため、多塩基酸の滴定曲線は、各酸性プロトンに 1 つずつ、互いに結合した複数の「通常の」(一塩基性) 滴定曲線のように見えます。強塩基で滴定されたジプロトン酸 (硫酸など) を表す以下の曲線を考えてみましょう。
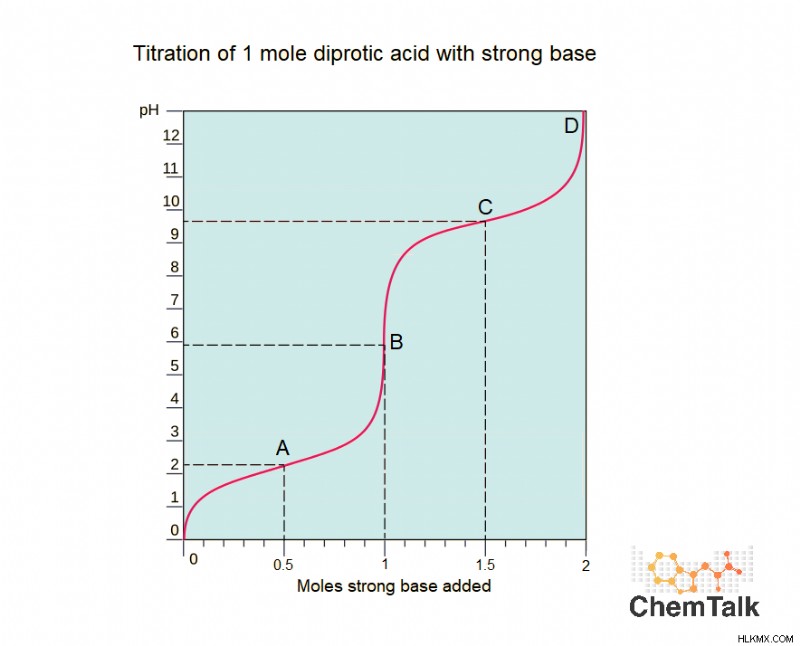
この曲線には、A、B、C、D とラベル付けされた 4 つの特徴的な点があります。
A点
ポイント A では、0.5 モルの塩基が追加されました。これは、ジプロトン酸の半分が脱プロトン化されたことを意味します。これは、酸の半分にプロトンが残っていないことを意味しますか?いいえ!これは、酸の半分が 1 つの陽子を失い、まだ 1 つ残っていることを意味します。残りの半分には両方の陽子があります。この時点で、ソリューションはバッファーです。緩衝液とは何かについては、リンクされた記事を参照してください。元の酸の半分が共役塩基に変換されているため、溶液は緩衝液です。ポイント A はバッファリング領域、具体的には最初のバッファリング領域と呼ぶことができます。
ポイント B
ポイント B では、1 モルの強塩基が追加されています。最初の陽子は常に 2 番目の陽子よりも酸性であることを思い出してください。これは、元の酸のすべてが最初の陽子を失い、最初の陽子だけを失ったことを意味します。点 B は等価点と見なされます。 1 つの当量点しかない通常の滴定とは異なり、多塩基酸の滴定には複数の点があり、それぞれが連続する各酸性プロトンの完全な損失に対応します。
ポイント C
この時点で、検体の半分は両方の陽子を失い、残りの半分はまだ 1 つ残っています。酸と共役塩基の 50/50 混合物であるため、緩衝剤と見なされます。
ポイント D
点 D は、2 番目の (そして最後の) 等価点です。ポイント D では、元の酸はすべて完全に脱プロトン化され、塩基に変換されています。
さらに読む
- pKaとは
- 均衡
- 緩衝液とは
- ICE テーブルの使用