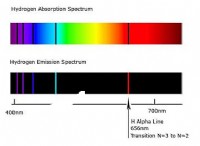
それが何であるか:
* プラチナ電極: 電極はプラチナで作られており、化学的に不活性であり、反応を触媒します。
* H+イオンの溶液に浸されています: 電極は通常、塩酸(HCl)または他の酸の溶液に浸水し、反応にH+イオンを提供します。
* 水素ガスと接触している(H2): 水素ガスはプラチナ電極上で泡立てられ、電極の周りの水素ガスの一定の圧力が確保されます。
反応:
プラチナ電極では、次の可逆反応が発生します。
* 削減: 2H + + 2E-→H2(水素イオンは電子を獲得して水素ガスになります)
* 酸化: H2→2H + + 2E-(水素ガスは電子を失い、水素イオンになります)
重要な特性:
* リバーシブル: 反応は両方向に進むことができ、基準電極として適しています。
* 標準電位: 電極の電位は、標準条件で0ボルト(298 K、1気圧、および1 M濃度のH+イオン)として定義されます。この標準電位は、他の電極のポテンシャルを測定するための基準点として使用されます。
* 安定性: 電極は非常に安定しており、再現性があり、信頼できる基準点になります。
使用方法:
* 電極電位の測定: 水素電極が別の電極に接続されている場合、2つの電極間の電位の差を測定できます。この違いは、他の電極の可能性です。
* 平衡定数の決定: 反応中の水素電極と別の電極の間の電位差を測定することにより、反応の平衡定数を計算できます。
* 電気化学プロセスの研究: 水素電極は、腐食、バッテリー性能、電気化学反応の速度論など、さまざまな電気化学プロセスを研究するために使用されます。
注: 水素電極は電気化学の貴重なツールですが、実際にセットアップして維持することは困難です。塩化銀/銀銀(AG/AGCL)電極などの他の参照電極は、使いやすさと安定性のために実際の用途でよく使用されます。