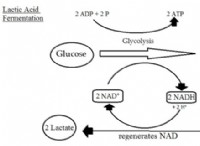
これが故障です:
* グラム同等物: これは、1モルの水素イオン(H+)または水酸化物イオン(OH-)と反応する物質の量を表します。考慮される化学反応に依存します。
* 正常(n): 溶質のグラム相当数をリットルの溶液の体積で割ることによって計算されます。
式:
正常(n)=(溶質のグラム相当の数) /(リットルの溶液の体積)
例:
硫酸の1 m溶液(h₂so₄)があるとしましょう。
*この反応では、h₂SO₄は2つの陽子(H+)を寄付できます。
*したがって、1モルのh₂so₄は2グラム相当に相当します。
*この溶液の正常性は2 n(1モルx 2グラム相当/モル=2グラム相当)になります。
なぜ正規性を使用しますか?
* 化学量論: 特に酸塩基反応と酸化還元反応について、化学量論計算を簡素化します。
* 滴定: 既知の正常性の溶液と反応することにより、未知の溶液の濃度を決定している滴定反応に特に役立ちます。
重要な考慮事項:
*正常性は特定の反応に依存します 考慮されている。
*それはモル塩分(mol/L)のような標準単位ではなく、その使用は減少しています。
*現代の化学は、しばしばそのシンプルさとより広い適用性のためにモラリティを支持します。
要約すると、正常性は、溶液のリットルあたりのグラム相当数に基づいて、物質の反応能力に焦点を当てた濃度単位です。今日ではあまり一般的ではありませんが、滴定や酸塩基化学などの特定のコンテキストでは価値があります。