主な違い – 原子軌道と分子軌道
軌道は、電子を見つける確率が高い領域として定義されます。原子は、原子核の周りを回転する独自の電子を持っています。これらの軌道が重なり合って結合して分子になったものを分子軌道と呼びます。原子価結合理論と分子軌道理論は、それぞれ原子軌道と分子軌道の性質を説明します。軌道は最大 2 つの電子を保持できます。原子軌道と分子軌道の主な違いは、原子軌道の電子は 1 つの正の原子核の影響を受けることです。 、一方、分子軌道の電子は、分子内の原子の数に応じて 2 つ以上の原子核の影響を受けます .
この記事では、
1.原子軌道とは
– 定義、特性、プロパティ
2.分子軌道とは
– 定義、特徴、機能
3.原子軌道と分子軌道の違いは何ですか

原子軌道とは
原子軌道は、電子を見つける確率が最も高い領域です。量子力学は、原子の電子の位置の確率を説明します。与えられた時間のプロンプトでの電子の正確なエネルギーを説明するものではありません.ハイゼンベルクの不確定性原理で説明されています。原子の電子密度は、シュレディンガー方程式の解から求めることができます .原子軌道は、最大 2 つの電子を持つことができます。原子軌道は、s、p、d、および f サブレベルとしてラベル付けされます。これらの軌道はさまざまな形をしています。 s 軌道は球形で、最大 2 つの電子を保持します。サブエネルギーレベルが 1 つあります。 p軌道はダンベル型で、最大6個の電子を保持できます。 3 つのサブエネルギー レベルがあります。 d 軌道と f 軌道は、より複雑な形状をしています。 d準位には5つのサブエネルギーグループがあり、最大10個の電子を保持しますが、fレベルには7つのサブエネルギーレベルがあり、最大10個と15個の電子を保持できます。軌道のエネルギーは s
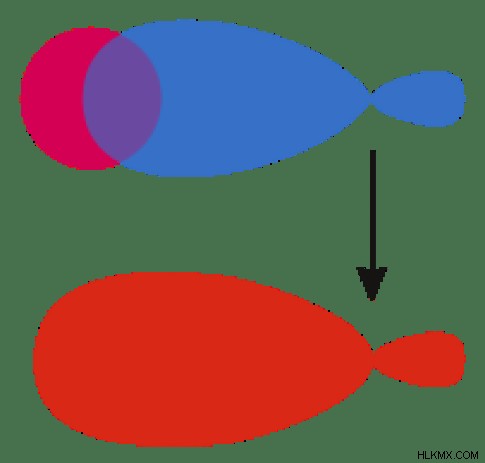
図 1:原子軌道の種類 分子軌道の性質は、分子軌道理論によって説明されます。 F. Hund と R.S. によって最初に提案されました。分子軌道理論によると、原子が融合して分子を形成するとき、重なった原子軌道は原子核の影響で形を失います。分子に存在する新しい軌道は、分子軌道と呼ばれるようになりました。分子軌道は、ほぼ同じエネルギーの原子軌道の組み合わせによって形成されます。原子軌道とは異なり、分子軌道は分子内の単一の原子に属していませんが、分子を構成するすべての原子の原子核に属しています。したがって、異なる原子の核は多中心核として振る舞います。分子軌道の最終的な形状は、分子を構成する原子軌道の形状に依存します。 Aufbau ルールによると 、分子軌道は低エネルギー軌道から高エネルギー軌道まで満たされています。原子軌道と同様に、分子軌道は最大数の 2 つの電子を保持できます。ただし、パウリの原則によると 、これらの 2 つの電子は反対のスピンを持っている必要があります。分子軌道における電子の振る舞いは、シュレディンガー方程式を使用して記述できます。 .しかし、分子は複雑なため、シュレディンガー方程式の適用は非常に困難です。したがって、科学者は、分子内の電子の挙動を近似的に評価する方法を開発しました。この方法は原子軌道の線形結合と呼ばれます (LCAO) メソッド。
図 2:分子軌道の形成
原子軌道: 原子軌道は、原子内で電子を見つける可能性が最も高い領域です。 分子軌道: 分子軌道は、分子の電子を見つける可能性が最も高い領域です。
原子軌道: 原子軌道は、原子の周りの電子雲によって形成されます。 分子軌道: 分子軌道は、ほぼ同じエネルギーを持つ原子軌道の融合によって形成されます。
原子軌道: 原子軌道の形状は、原子軌道のタイプ (s、p、d、または f) によって決まります。 分子軌道: 分子軌道の形状は、分子を構成する原子軌道の形状によって決まります。
原子軌道: シュレディンガー方程式
分子軌道: 原子軌道の線形結合 (LCAO) が使用されます。
原子軌道: 原子軌道は、単一の核の周りにあるため、単心です。
分子軌道: 分子軌道は、異なる核の周りに見られるため、多中心です。
原子軌道: 単核は原子軌道の電子雲に影響を与える
分子軌道: さらに 2 つの原子核が分子軌道の電子雲に影響を与えます。 原子軌道と分子軌道は、それぞれ原子と分子で最も高い電子密度を持つ領域です。原子軌道の性質は、原子の単一核によって決定されますが、分子軌道の性質は、分子を形成する原子軌道の組み合わせによって決定されます。これが原子軌道と分子軌道の主な違いです。
参考文献: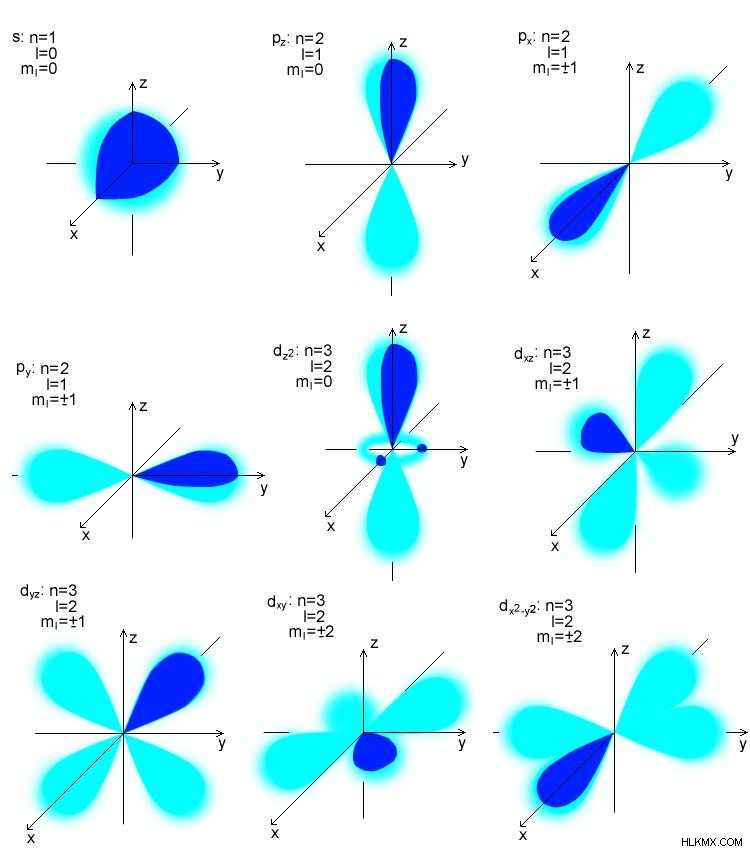
分子軌道とは
原子軌道と分子軌道の違い
定義
フォーメーション
形状
電子密度の説明
核
核の効果
まとめ
1. Verma, N. K., Khanna, S. K., &Kapila, B. (2010). 総合化学 XI.
2. Ucko, D. A. (2013). 化学の基礎 Elsevier.
3. Mackin, M. (2012).化学の基礎に付随する学習ガイド .エルゼビア。