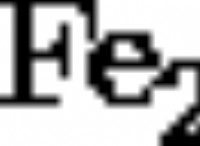1。電解質: 塩水は電解質として機能します。つまり、電気を導入できる溶存イオンが含まれています。
2。電解細胞の形成:
* アノード: 鉄(Fe)は、酸化が発生するアノードとして機能します。
* カソード: 炭素などの鉄の不純物は、還元が発生するカソードとして機能します。
* 電解質: 塩水は、イオンの動きの媒体を提供します。
3。アノードでの酸化: 鉄原子は電子を失い、鉄(II)イオン(Fe²⁺)を形成します。
* fe(s)→fe²⁺(aq) +2e⁻
4。カソードでの削減: 水からの酸素が減少し、電子を獲得します。
*o₂(g) +4h⁺(aq) +4e⁻→2h₂o(l)
5。錆の形成: 鉄(II)イオンは、水から水酸化物イオン(OH⁻)と反応し、鉄(II)水酸化物(Fe(OH)₂)を形成します。
*fe²⁺(aq) +2oh⁻(aq)→fe(oh)₂(s)
鉄(II)水酸化物は酸素と水の存在下で不安定であり、さらに酸化されて酸化鉄(III)を形成します。 (Fe₂o₃・xh₂o)。
錆びを促進する要因:
* 塩の存在: 塩はより多くのイオンを提供し、電解質の導電率を高めます。
* 温度: 温度が高いほど、化学反応の速度が上がります。
* 酸素: 酸素は錆の形成に不可欠です。
* 酸性度: 酸性条件(低pH)は腐食プロセスを高速化します。
錆の防止:
* コーティング: 塗料、油、グリースなどの保護コーティングを塗ると、鉄と環境の間に障壁が生まれます。
* 亜鉛メッキ: 犠牲のアノードとして機能する亜鉛の層で鉄をコーティングすると、鉄を腐食から保護します。
* 合金: 他の金属を鉄に追加して、ステンレス鋼などの合金を形成すると、腐食に対する耐性が高まります。