その理由は次のとおりです。
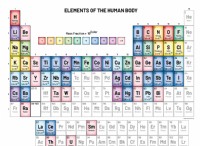
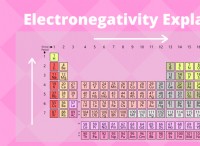
* 電気陰性度: これは、結合中に電子を引き付ける原子の能力の尺度です。
* 極性共有結合: このタイプの結合は、1つの原子が共有電子により強い引っ張りを持ち、1つの原子に部分的な正電荷と他の原子に部分的な負電荷を作成すると形成されます。
* 非極性共有結合: 電気陰性度が類似している場合、共有電子は両方の原子によって平等に引き付けられます。これは、有意な電荷分離がなく、結合は非極性と見なされることを意味します。
非極性共有結合を形成する同様の電気陰性度を持つ元素の例:
* h-h (水素ガス)
* cl-cl (塩素ガス)
* o =o (酸素ガス)
重要な注意: 「非極性」と見なされる結合でさえ、電気陰性度には常に小さな違いがあります。ただし、違いは非常に小さいため、実際の目的では無視できると考えられています。