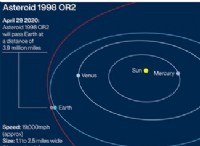
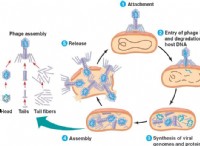
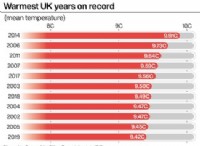
これが故障です:
* 価電子: これらは、化学結合に関与する原子の最も外側の殻の電子です。
* 貴重なガス: これらの要素には完全な外側のシェルがあり、非常に安定して不活性なシェルを備えています。
* オクテットルール: 原子は、電子を獲得、失い、または共有する傾向があり、8原子価電子を持つ完全な外側シェルを実現する傾向があります(ヘリウムを除く2つのヘリウムを除く)。
なぜこれが起こるのか:
* 静電引力: 電子は負に帯電しますが、核は正に帯電します。原子はこれらの料金のバランスを求めて努力します。完全な外側のシェルを持つことは、電子が核によってしっかりと保持されるため、このバランスを提供します。
* 安定性: 完全な外殻を持つ原子はエネルギーが低く、他の原子と反応する可能性が低くなります。
例:
* ナトリウム(Na): 1価電子が1つあります。この電子を失うことにより、ネオン(NE)のような安定した電子構成で正の帯電イオン(Na+)になります。
* 塩素(cl): 7つの価電子があります。 1つの電子を獲得することにより、Argon(AR)のような安定した電子構成で負に帯電したイオン(CL-)になります。
* 酸素(O): 6つの価電子があります。 2つの共有結合を形成して、2つの電子を別の原子と共有し、オクテットを完成させます。
オクテットルールの例外:
* 水素(H): 完全な外側のシェルを実現するには、2つの電子のみが必要です。
* 第3期およびそれ以降の要素: D軌道が利用可能であるため、8つ以上の価電子を持つことができます。
要約すると、オクテットのルールは、8つの原子価電子を持つために電子を獲得、紛失、または共有することにより、貴族の安定性を達成するよう努めているため、代表的な要素の反応性と結合挙動を説明するのに役立ちます。