
原子半径の傾向 原子半径の説明 元素の周期表を移動すると変化します。一般に、元素の原子半径は、周期表の元素グループを下に移動するにつれて大きくなる傾向があります。
なぜこのようなことが起こるのかを理解するには、原子半径の定義と周期表のさまざまな元素の半径を詳しく調べると役に立ちます。
原子半径とは
原子半径は、原子の大きさを表します。しかし、この値を特定するのは、思っているほど簡単ではありません。まず第一に、原子半径という用語は原子のサイズを指すために使用されますが、この値について合意された定義がないという事実に注意することが重要です。原子半径の測定には、イオン半径、金属半径、共有結合半径、ファン デル ワールス半径など、さまざまな方法が使用されます。
イオン半径は、結晶格子内にあるときの原子のイオンの尺度を指し、通常、ほとんど触れていない 2 つの異なるイオンの核間の距離の半分です。共有結合半径は、共有結合の一部を構成する原子のサイズです。金属半径は、正に帯電した金属イオンと伝導電子の間の特定のタイプの化学結合を指します。金属半径は通常、金属格子内で互いに隣接する 2 つの金属イオン間の距離の半分として定義されます。ファン デル ワールス半径は、定義された要素内の 2 つの非結合原子の最も接近した距離の間に存在する距離を指します。
原子半径トレンドとは?
原子半径はさまざまな方法で定義できますが、周期表全体の一般的な原子半径の傾向は当てはまります。元素の原子の原子半径は、表内の元素のグループを下に移動するにつれて大きくなる傾向があります。表の新しい行ごとに新しい電子殻が原子に追加されるため、列を下に移動すると原子半径が増加します。
これの当然の帰結は、原子番号が増加するにつれて原子あたりの電子数が増えるため、表を左から右に横切るにつれて原子半径が減少する可能性があるということです.
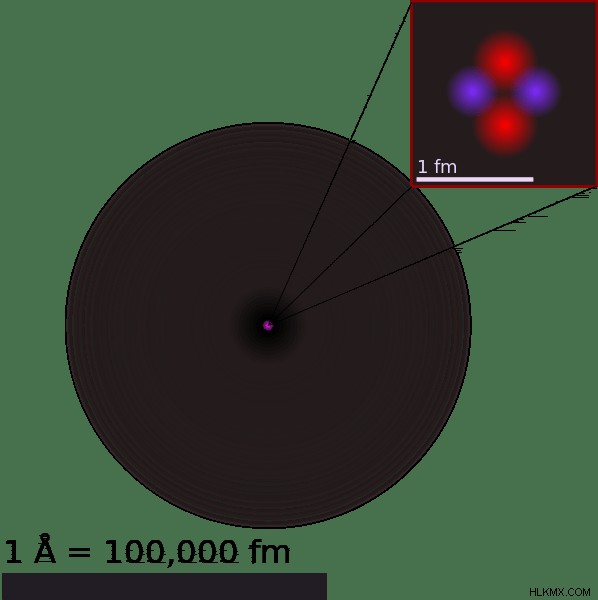
原子半径はどのように測定されますか?
原子は絶えず動いているため、原子半径を測定しようとすると、ある程度の誤差が組み込まれます。原子半径の測定は、かろうじて接触している 2 つの異なる原子の原子核間の距離を測定することによって行われます。 2 つの原子核間の距離の直径を 2 で割り、半径を取得します。原子半径を測定するときは、測定対象の原子がそれらの間で化学結合を共有できないことを覚えておく必要があります。これは、化学結合が、原子の電子殻が重なるか、外殻を共有することを意味するためです。
原子半径とイオン半径の違い
イオン半径と原子半径は、クリプトン、ネオン、アルゴンなどの中性元素の原子に相当します。しかし、多くの原子は、正味の正電荷を持っているときに最も安定しています。実際には、これは、最も外側の電子を落とすと陽イオン (正に帯電したイオン) になることを意味します。電子が原子から脱落するとき、原子はその最も外側の電子殻も脱落することが多く、これは原子半径をイオン半径よりも大きくする効果があります.
一部の原子は正電荷でより安定しているという事実とは対照的に、正味の負電荷でより安定している原子もあります。この場合、1 つまたは複数の電子を獲得し、陰イオン (負に帯電したイオン) になることで、より安定します。ただし、別の電子殻は追加されません。つまり、イオン半径と原子半径のサイズの違いは、陽イオンに存在する違いほど大きくありません。これは、原子半径が常に同じか、イオン半径よりわずかに小さいことを意味します。一般に、イオン半径の傾向は原子半径と同様の傾向があり、周期表を移動するにつれてサイズが大きくなります。
周期表に見られるその他の傾向
原子半径の傾向とは別に、周期表には他の傾向があります。周期表に見られるその他の傾向には、電気陰性度の傾向、イオン化エネルギーの傾向、および電子親和力の傾向が含まれます。
電気陰性度の傾向は、要素のセクションを左から右に移動すると、原子の電気陰性度の値が増加するという事実を反映しています。表のグループを上から下に移動すると、電気陰性度も減少します。電気陰性度の傾向に対する注目すべき例外には、イアンタニド、アクチニド、および希ガスが含まれます。遷移金属は、それらにほとんど変動がありません。
イオン化エネルギーの傾向とは、気体の中性原子から電子を除去するために必要なイオン化エネルギーの量が、周期表全体でどのように変化するかを指します。周期表の右側にある元素は、通常、陽イオンになるのにより多くのイオン化エネルギーを必要としますが、表の左側にある元素は通常、より容易に陽イオンになります。言い換えれば、テーブルを左から右に横切るにつれて、イオン化エネルギーが増加します。
電子親和力の傾向は、原子の電子親和力、つまり特定の原子が電子と結合する能力を追跡します。原子の電子親和力の値が低いほど、原子は電子を受け入れやすくなります。電子親和力は、通常、要素のグループを下に移動すると低下します。周期表を左から右に移動すると、電子親和力が増加します。
原子半径の例
原子半径の例をいくつか簡単に見てみましょう。これらの原子半径はピコメートル単位で測定されます:
- 元素水素 (H) の原子半径は 37 です。
- ナトリウム (Na) の原子半径は 186 です。
- カリウム (K) の原子半径は 227 です。
- ルビジウム (Rb) の原子半径は 248 です。
- セシウム (Cs) の原子半径は 265 です。
これらの元素はすべて周期表の最初の列にあり、降順で表示されていることに注意してください。これは、周期表を下に移動するにつれて、原子半径がどのように増加するかをきちんと示しています。







