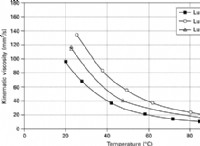
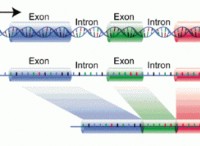
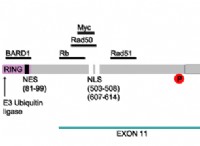
1。水の解離:
- 水分子(H2O)は、1つの酸素原子に結合した2つの水素原子で構成されています。
- 電流が適用されると、水分子は電気分解と呼ばれるプロセスを通じて水素(H2)と酸素(O2)ガスに解離します。
2。水素と酸素の形成:
- 水素ガス(H2)はカソード(負の電極)で生成され、そこでは積極的に帯電した水素イオン(H+)ゲイン電子を獲得し、水素ガス分子を形成するように還元されます。
- 酸素ガス(O2)はアノード(陽性電極)で生成されます。ここでは、負に帯電した水酸化物イオン(OH-)が電子を失い、酸化して酸素ガス分子を形成します。
3。ガスバブル:
- 水素と酸素ガスが生成されると、それらは水面に上昇する目に見える泡を形成します。
- 泡は、純粋な水素と酸素ガスで構成され、さまざまな用途に収集および利用できます。
4。 pHの変化:
- 電気分解中、水酸化物イオン(OH-)の蓄積により、カソード近くの水はわずかにアルカリ性になりますが、水素イオン(H+)の形成によりアノードの近くの水はわずかに酸性になります。
5。化学反応:
- 電気分解は、水中の他の化学反応を促進する可能性もあります。水に存在する溶存ミネラル、塩、および不純物は、生成された水素および酸素ガスと反応し、新しい化合物または物質を形成する可能性があります。
6。電解質:
- 純水は電気の導体が貧弱ですが、溶解した塩、酸、または水中の塩基の存在により、電流がより簡単に流れるようになります。これらの物質は電解質として知られています。
7。腐食:
- 電気分解で使用される電極は、化学反応と電気分解中に発生する酸化還元プロセスにより腐食を受ける可能性があります。
電気分解中の特定の反応と結果は、水質、溶解した物質、電極材料、およびその他の実験条件によって異なる場合があることに注意することが重要です。