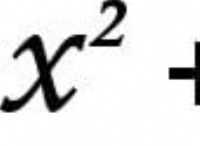その理由は次のとおりです。
* 分子間力: これらは分子間の引力の力です。それらは、分子内で原子を一緒に保持する力よりもはるかに弱いです。これは、電子分布の一時的な変動または永久双極子間の相互作用から生じるためです。
* 分子内の力: これらは、原子を分子内で一緒に保持する力です。それらは、原子間の電子の共有を伴うため、分子間の力よりもはるかに強いです。
分子間力のタイプ:
* van der Waals Force: これらは最も弱いタイプの分子間力であり、電子分布の一時的な変動から生じます。それらはすべての分子に存在します。
* 双極子型力: これらの力は、永久双極子を持つ極性分子間で発生します。
* 水素結合: これは最も強力なタイプの分子間力であり、水素原子が高電気陰性の原子(酸素、窒素、フッ素など)に結合したときに発生します。
例:
*水分子は、比較的強い水素結合によって結合されており、水が高い沸点を持っている理由を説明しています。
* Nobleガス原子は、それらの間に弱いファンデルワールスの力しかないため、非常に低い沸点があります。
分子間の力は分子内の力と比較して弱いが、融点、沸点、粘度など、物質の物理的特性を決定する上で重要な役割を果たしている。