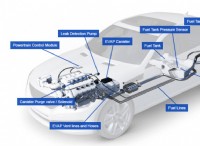
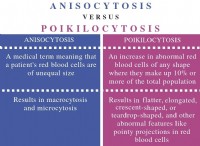
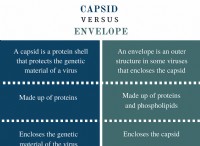
* シェル1(n =1):
* サブシェル: 1秒
* 電子: 2(1S²)
* シェル2(n =2):
* サブシェル: 2s、2p
* 電子: 8(2S²2P⁶)
説明:
* シェル: 電子は、主要な量子数(n)で示されるシェルと呼ばれる特定のエネルギーレベルを占めます。最初のシェル(n =1)は核に最も近く、2番目のシェル(n =2)などが続きます。
* サブシェル: 各シェル内にサブシェル(S、P、D、F)があります。サブシェルのエネルギーレベルと形状はわずかに異なります。
* 軌道: サブシェルは原子軌道で構成されています。各軌道は、最大2つの電子を保持できます。
* 電子構成: 電子構成では、電子がシェルとサブシェルにどのように分布するかを説明します。
最初の2つのシェルの電子構成の内訳です:
* シェル1: 1つの軌道を持つ1Sサブシェルのみが含まれています。この軌道は、最大2つの電子を保持できます。
* シェル2: 2つのサブシェルが含まれています。
* 2sサブシェル: 1つの軌道があり、2つの電子を保持できます。
* 2pサブシェル: 3つの軌道(2px、2py、2pz)があり、合計6つの電子(各軌道に2つ)を保持できます。
したがって、最初の2つのシェルの完全な電子構成は1S²2S²2P⁶であり、合計10電子になります。