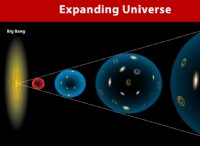
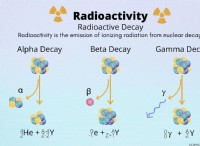
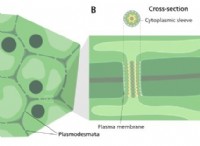
その理由は次のとおりです。
* 電子構成: アルカリ金属には、最も外側の電子がS軌道にある特徴的な電子構成があり、この軌道は半分しか充填されていません。たとえば、リチウム(LI)は1S²2S¹、ナトリウム(Na)の電子構成が1S²2S²2p⁶3S¹などです。
* 反応性: S軌道のこの単一の電子は比較的ゆるく保持され、簡単に除去され、アルカリ金属は非常に反応します。彼らはこの電子を失い、+1カチオンを形成する傾向があるため、非金属とのイオン結合を容易に形成します。
* グループ1: アルカリ金属は、周期表のグループ1に属します(最初の列)。
他に質問がある場合はお知らせください!