この記事では、イオン結合と共有結合について説明し、イオン結合と共有結合を比較します .イオン結合とは何か、共有結合とは何かについてお話します。また、両方の例を示します。一般的な食卓塩は、イオン結合を持つ一般的な化合物の例です。イオン性化合物はしばしば固体であり、結晶を形成します。
私たちが肺から吐き出す二酸化炭素は、共有結合を持つ化合物です。しかし、イオンと共有の違いは何ですか?
共有結合とは?
共有結合とは何ですか?化学結合には、主に共有結合とイオン結合の 2 種類があります。 共有結合の定義 、かなり均等に共有されている原子間に電子がある結合です。平等に共有されるほど、共有性が高くなります
共有結合は、2 つの非金属または非金属と半金属の間に発生します。共有結合には、極性と非極性の 2 種類があります。非金属間、または非金属と半金属間の結合には、大きな電気陰性度の違いはありません。
具体的には、共有結合内の原子間の電気陰性度の差は 1.7 を超えません。原子間の同様の電気陰性度の結果として、原子は電子を共有します。たとえば、酸素の価電子は、水素の外側の電子殻を完成させます。同様に、水素の価電子は、酸素の最も外側の電子殻を完成させます。ここに共有結合の面白い画像があります.
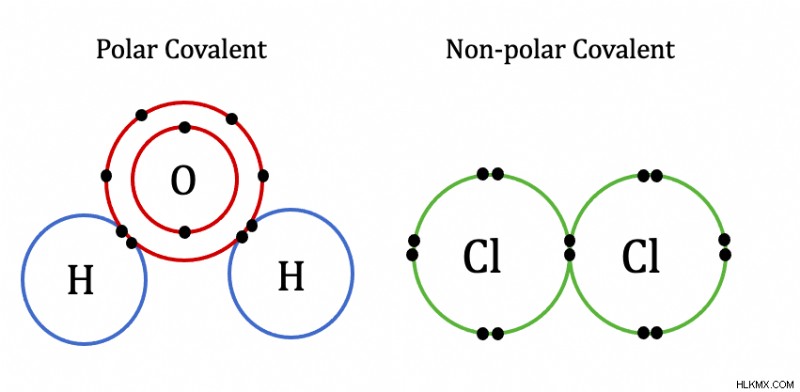
イオンの定義
「イオン」という言葉の定義は、荷電した原子または分子であるイオンに関連する、またはイオンを含むものです。イオン結合、イオン化合物、イオン化があります。これらの概念はすべてイオンに関係しています。
イオン結合とは?
では、イオン結合とは何でしょう? イオン結合の定義 、電子が(ほとんど)ある原子から別の原子に移動する原子間の結合です。原子間で常にいくらかの電子の共有があるため、ほとんどと言いますが、イオン結合では、共有は非常に不平等です.電子の共有が等しくないほど、イオン性が高くなります
イオン結合は、金属と非金属の間に発生します。共有結合とは異なり、イオン結合は原子間で価電子を移動します。イオン結合では、非金属と金属の電気陰性度の差は 1.7 を超えます。金属原子は、その電子を非金属原子に移動します。したがって、金属原子は正に帯電した陽イオンになり、非金属原子は負に帯電した陰イオンになります。その結果、イオン結合は 2 つの荷電イオンを作成し、金属は常にその電子を供与し、非金属は常に電子を受け取ります。イオン結合の例は、塩である塩化ナトリウムの結合です。ナトリウムの価電子は、塩化物の外側の電子殻に移動します。
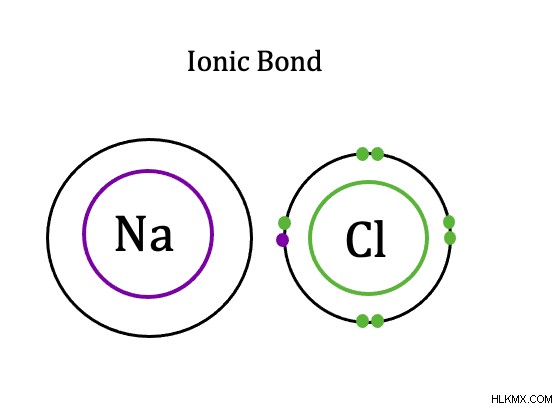
イオン結合を持つ分子は、イオン化合物を形成します。共有結合を持つ分子は、共有結合化合物を形成します。共有結合は壊れやすいため、共有結合化合物は低温で融解することがよくあります。イオン結合と共有結合、および化合物をもう少しよく理解していただければ幸いです。
NaCl はイオン性ですか、それとも共有結合性ですか?
NaCl、塩化ナトリウム、または食卓塩は、イオン性化合物の「典型的な」例です。ナトリウムは金属、塩素は非金属です。それはイオン結合を持ち、結晶構造を持っています。溶液中では、溶液中のイオンに分離します。
イオン化合物の性質
共有結合とイオン結合を持つ化合物の違い
イオン化合物の定義 、静電力によって一緒に保持されたイオンで構成される化合物です - 基本的にイオン結合によって一緒に保持されます。それらは、正反対の電荷を持つきれいに詰まったイオンによって形成されます。化合物は中性ですが、正および負に帯電した陽イオンと陰イオンで構成されています。イオン結合と共有結合および化合物のいくつかの違いを見てみましょう。
<オール>これにより、イオン対共有結合の理解が深まることを願っています。
イオン結合を持つ化合物の例
以下はイオン結合の例です:
- 塩化ナトリウム、NaCl
- 硫酸マグネシウム、MgSO4
- フッ化セシウム、CeF
- 水酸化ストロンチウム、Sr(OH)2
- シアン化カリウム、KCN
共有結合を持つ化合物の例
以下は共有結合の例です:
- 水、H2 ああ
- メタン、CH4
- アンモニア、NH3
- ヨウ化スズ (IV)、SnI4
- 塩化チタン (IV)、TiCl4
インタラクティブな周期表の詳細
元素、傾向、電気陰性度、発見日、イオンなどの特性を調べることができる、銀河で最高のインタラクティブな周期表を発表しました。
イオン vs 共有 – 参考文献
共有結合化合物の命名
イオン化合物の命名
極性結合と非極性結合
極性共有結合







