分子の結合順序は、それを説明するすべての可能な構造の結合順序の平均です。
量子力学が発展する 20 年前、アメリカの科学者 G.N.ルイスは、分子が特定の原理に従って結合し、組織化しなければならないことに気付きました。彼の理論は、イオン結合とは異なり、価電子の交換を必要とせず、代わりにそれらの一部を共有する原子を必要とする共有結合を中心にしていました。原子は、原子価殻を完全に満たすのに必要な数の電子を共有します。
原子価結合理論による結合順序
ルイスは、この友情を説明するために小さな図を描きました。これは現在、ルイス構造と呼ばれています。ルイス構造は、原子を線で結ぶことによって分子の構造を表します。線は、2 つ以上の原子間で共有されている電子の数を表します。したがって、2 つの原子が 2 つの電子を共有している場合、それらを 2 本の線で結んで表現します。行の数、より正確には、分子を構成する化学結合の数は、その結合順序と呼ばれます。
たとえば、二酸化炭素とメタンの結合次数は 4 であり、これはルイス構造を調べることで簡単に識別できます。各ペア間で共有される電子の大きさが、両方の原子の原子価殻を適切に満たす方法に注目してください。水素は 8 個ではなく 2 個の電子を含むと殻が満たされるため、1 個の電子しか必要としません。
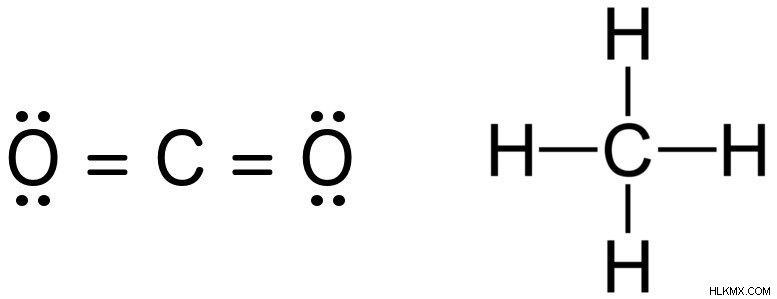
二酸化炭素とメタンのルイス構造。
二酸化硫黄など、複数のルイス構造で記述できる分子も存在します。そのような分子の結合順序は、それを記述するすべての可能な構造の結合順序の平均です。したがって、二酸化硫黄の結合次数は 3 ではなく 1.5 です。
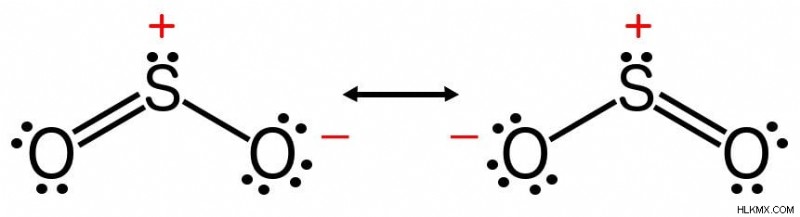
二酸化硫黄は 2 つのルイス構造を示します。
ただし、分子のルイス構造の線の数を参照するだけで結合次数を計算することは、原子価結合 (VB) 理論の下でのみ許容されます。分子結合を説明する別の理論である分子軌道 (MO) 理論に関して言えば、結合順序は同じかもしれませんが、意味合いは大幅に異なります。
原子価結合理論 vs 分子軌道理論
原子価結合理論は分子構造の大まかな表現を提供しますが、分子軌道理論は分子がどのように形成されるかについてより正確で現実的な表現を提供します。前者では、原子の上のドットで表された電子がどのように局在 されているかを観察できます。 それらの場所が明確であることを意味します。一方、MO理論は原子の量子力学理論に基づいています。確率的または ローカライズされていない 電子の性質と関連する明確なエネルギー準位.
VB 理論は理解しやすいですが、非常に難解で洗練された概念の助けを借りて MO 理論が説明する非常に重要な詳細を説明していません。ただし、この幾何学の理解と分子構造の詳細は、素人が簡単に視覚化できるという犠牲の上に成り立っています。

(写真提供:Pixabay)
これが、MO 理論の意味がしばしば劇的に異なる理由です。たとえば、酸素分子の結合次数は両方の理論で 2 であることがわかっていますが、VB 理論では酸素が示す常磁性特性を説明できません。実験は、液体酸素が磁場によってどのように弱い影響を受けるかを実証しました。不対電子を含む原子は、あらゆるタイプの磁性を示します。酸素のルイス構造を参照すると、すべての電子が対になっていることがわかります。これにより、原子は反磁性または磁場の影響を受けなくなります。しかし、MO 理論は酸素の構造を詳細に明らかにします。 MO 理論は、酸素の軌道に不対電子が存在すること、したがってその常磁性を正しく予測しています。
分子軌道理論を使用して結合順序を見つける方法
ただし、特定の軌道の電子数を決定する前に、まずこれらの軌道を電子で満たす必要があります。軌道を満たすには、どの軌道が占有されているかによる規則を知っている必要があります。このルールを理解していなければ、分子の結合順序を計算することは不可能です。数字にたどり着くための巧妙なトリックや近道はたくさんあると思いますが、それらを学んでしまうと、重要な概念的知識が失われてしまいます。
ルールを知っている人は、この式を参照して分子の結合順序を計算できます:

知らない人は学ぶしかありません。それが役立つ場合は、原子軌道を満たすためのルールを簡単に学ぶことができます.分子軌道を満たす規則は同じですが、各「結合」軌道の後に「反結合」軌道が続く点が異なります。原子軌道は 1s2s2p… のように満たされますが、 分子軌道は 1s1s*2s2s*2p… のように埋められます。 アスタリスク付きの軌道は、反結合性軌道を表します。残念ながら、ここではルールを完全には説明しません。不必要に脱線してしまうからです。この記事でそれらを見つけることができます。
ルールを知っている人は、上記の式を使用して、たとえば酸素の結合順序を計算できます。合計すると、1 つの酸素分子は 12 個の価電子で構成されます。ここで、ルールに従って、電子は次のように配置する必要があります:
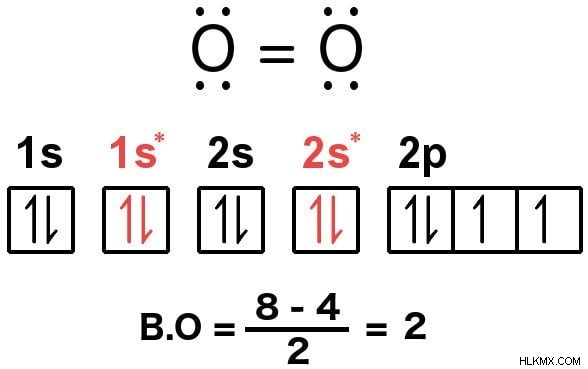
結合軌道に 8 個の電子が分布しているのに対し、反結合軌道に 4 個の電子が分布していることがわかります。式に数字を代入すると、酸素の結合次数が 2 であることがわかります。
2 つの軌道は、ジキルとハイドのようなものです。それらは同じジオメトリに存在しますが、反結合性軌道は悪名高い高いエネルギー レベルに存在し、電子の結合を安定させることができません。一方、結合性軌道は、電子が快適に移動できるエネルギーに存在します。結合し、得られた分子が安定性を達成できるようにします。実際、結合軌道のエネルギーは、電子が単一の原子に存在する個々の準位のエネルギーよりも低くなります。これは、電子が不対で存在するよりもむしろ結合して分子を形成することを意味します.
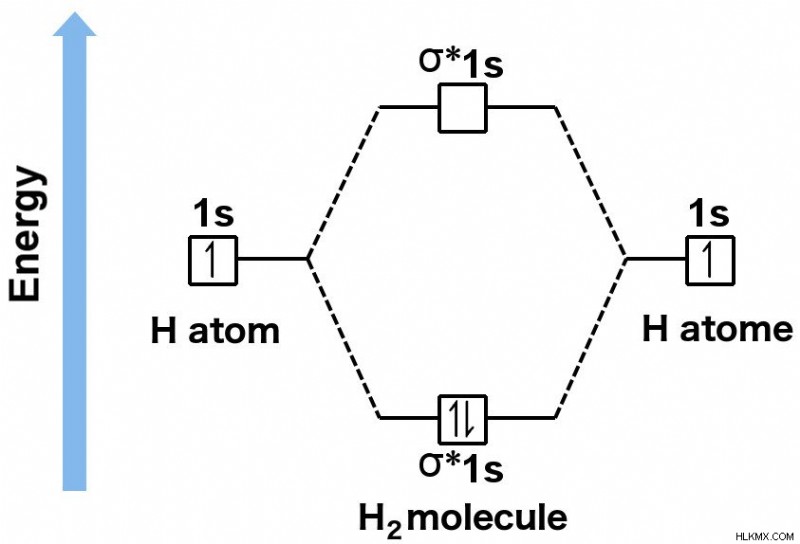
水素分子の結合軌道は、単一の水素原子の個々のレベルよりも低いエネルギーで存在します。これは、電子がペアになっていない状態で存在するよりも、むしろ結合して分子を形成することを意味します.
要約すると、MO 理論に精通していない場合は、ルイス構造を描画し、共有されている電子の総数を確認することで、分子の結合順序を計算できます (ルイス構造を描画するための厳密な規則が次のように存在します。よくわかりますが、読者はそれらを認識していると仮定します. そうでない場合は、このリンクを参照してください)。ただし、MO 理論に精通している場合は、まず規則に従って結合および反結合の分子軌道を価電子で満たすことによって結合順序を計算し、次に式を参照することができます。
分子の結合順序は、それを結合する結合の強さの尺度または指標を与えてくれます。結合は、両手を輪ゴムで縛るように原子を結び付けます。二重結合とは、輪ゴムが半分に折り畳まれ、手に結ばれていることを意味します。この新しい二重結合の強さにより、あなたの手はお互いに近づいています.分子はより安定になりました。同様に、3 つの結合または 3 つの折り畳みを使用すると、手をさらに近づけることができます。さらに、結合が強ければ強いほど、それを壊すのにより多くのエネルギーが必要になります.2つ折りまたは3つ折りのバンドよりも、1つ折りの輪ゴムで縛られた方が、手ははるかに簡単に解放されます.結合を切断するために必要なエネルギーは、分子の結合エネルギーと呼ばれます。







