化学式のバランスをとるには、矢印の両側にある各元素の原子数を数えることから始めます。次に、主要な要素 (水素と酸素は最後に残します) に適切な数を掛けてバランスを取り、最後に同じ方法で水素と酸素のバランスをとります。
材料が正しい割合で加えられなかった場合、食べ物の味はどうなりますか?
悪い?まったく食べられないかも?
食品と同様に、望ましい製品を形成するには、化学反応の成分 (反応物質) が正しい比率で存在する必要があります。
また、質量保存の法則は、質量は生成も破壊もされず、再配置のみが可能であると述べています。これはまさに化学反応で起こることです。反応原子は生成物を生成するために再配置されますが、この再配置 (反応) を受けても、各要素の量 (原子の数) は変わりません。
したがって、反応の化学式を書くときは、法則に従い、各要素の原子数が式の両側で等しいことを確認することが最も重要です。これが達成された場合、反応はバランスが取れていると言われます。

サノスと同じように、質量保存の法則では、すべての化学式が完全にバランスが取れている必要があります。
化学式とは?
手順を説明する前に、化学式を分析して、そのさまざまな構成要素にもう少し慣れましょう。化学式は、化学反応を説明するために化学記号と数字の配置が整然と詰め込まれ、提示されています。
化学式は、反応物半分と生成物半分の 2 つの部分にグループ化できます。反応物の半分は矢印の左側にあるもので、関与する各反応物の化学記号があり、反応物の反応によって生成された生成物は矢印の右側に書かれています.
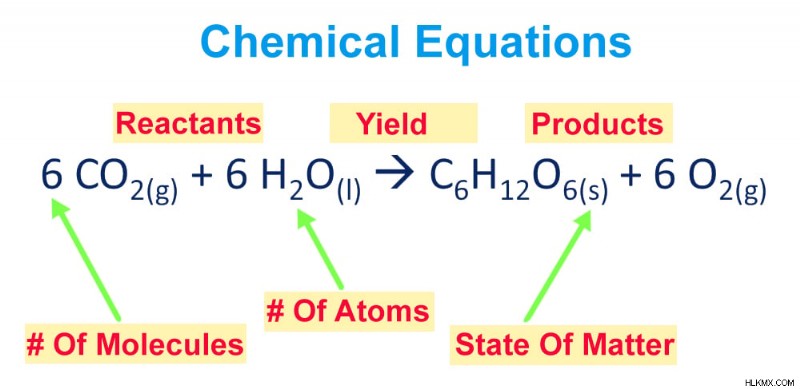
化学式の構成要素
さらに、各元素の物理的状態も、化学記号/化学式の後に添字形式で記載されています。下付き文字について言えば、化学記号の後に下付き文字で書かれた数字は、存在する元素の原子の数を示します。
各化学記号の前に付けられた係数は、方程式のバランスをとる行為から生じ、各元素/化合物の分子数に関する情報を伝えます.
化学式のバランスを取る方法
方程式のバランスを取ることは、脳外科手術とはかけ離れています。必要なのは、数の才能と基本的な手順に従う能力を持っていることだけです。手順は、反応式の検査から始まります。矢印の両側にある各要素の原子がカウントされます。それらが同じでない場合は、バランスを取るために次の手順が実行されます。
ステップ 1:各元素の原子数に注意してください
前述のように、反応の両側にある各元素の原子数を数えて書き留めることから始めます。大気中の窒素と水素の反応を考えてみましょう。この 2 つは反応してアンモニア (NH3) を生成し、この反応は「ハーバー ボッシュ プロセス」と呼ばれます。この反応のアンバランス方程式は次のとおりです:
N2 + H2 → NH3
調べてみると、式には 2 つの窒素原子と 2 つの水素原子が結合して、単一のアンモニア分子が生成されることがわかります。ただし、アンモニアには 3 つの水素原子がありますが、反応物側には 2 つしかありません。また、反応物側には、生成物側よりも窒素原子が 1 つ多くあります。明らかに、方程式は釣り合っておらず、質量保存の法則に従っていません。サノスはこれを承認しないので、彼がスナップする前にバランスを取りましょう!

ステップ 2:主要素から始める
化学式のバランスを取るときは、常に水素原子と酸素原子を最後に残してください (両方の側に存在することが多いため)。反応物の 1 つと生成物の 1 つだけに現れる元素から始めます。
この例では、水素以外の元素は窒素だけなので、バランスを取ります。反応物側には 2 つの窒素原子があり、生成物側には 1 つの原子があります。単純にアンモニアを 2 倍すると、窒素原子の数のバランスが取れます。方程式は次のようになります:
N2 + H2 → 2NH3
これで、どちらかの側に 2 つの窒素原子があるため、窒素のバランスが取れています。次は水素に移りましょう。
小さなテーブルも更新しましょう。

ステップ 3:水素原子と酸素原子のバランスをとる
最終ステップでは、水素原子と酸素原子のバランスをとります。表によると、水素原子の数は 6 に増えていますが、反応物側にはまだ 2 つの水素原子しかありません。 2 を 6 に変換するにはどうすればよいですか?それを 3 倍してみましょう!
N2 + 3H2 → 2NH3
これで、両側に 6 個の水素原子ができました。したがって、水素もバランスが取れています。表は次のようになります:

すべての要素のバランスが取れていることを確認するために、最終チェックを行いましょう。両側の窒素原子の数と水素原子の数は同じです。したがって、私たちの化学式は完全にバランスが取れています (すべてのものがあるべきです)。
バランスの取れた化学方程式の別の例
別の化学反応を考えて、バランスを取ってみましょう。結局のところ、練習は完璧になります。光合成反応はどうですか?この反応では、二酸化炭素と水が互いに反応して、グルコース (C6H12O6) と必要不可欠な酸素を生成します。不均衡な方程式は次のとおりです:
CO2 + H2O → C6H12O6 + O2

水素と酸素は後回しにして、両側の炭素原子の数のバランスを取りましょう。反応物側には炭素原子が 1 つしかありませんが、生成物グルコースには 6 つの炭素原子があります。 CO2 を 6 倍すると、炭素原子のバランスが取れます。したがって:
6CO2 + H2O → C6H12O6 + O2

では、水素に移りましょう。表によると、反応物側に 2 つの水素原子があり、矢印の反対側に 12 個の水素原子があります。 H2O を 6 倍すると、水素のバランスが取れます。
6CO2 + 6H2O → C6H12O6 + O2

バランスをとるために残っている唯一の要素は酸素です。反応物側には 18 個ありますが、生成物側には 8 個しかありません。グルコースに任意の数を掛けると、残りの要素のバランスが崩れるので、代わりに酸素の単独分子に注目しましょう。
これを 6 倍すると、合計 12 個の原子になります。これらがグルコースの既存の 6 個の酸素原子に追加されると、方程式のバランスが取れます。
6CO2 + 6H2O → C6H12O6 + 6O2

表によると、すべての要素が矢印の反対側に等量で存在します。したがって、私たちの方程式はバランスが取れています。
最後の言葉
いま学んだ方法(検査方法)とは別に、化学方程式のバランスを取る方法が 2 つあります。前者は代数方程式とその解き方の知識が必要ですが、後者は行列を利用してさらに複雑な方法を取ります。ただし、検査方法は 3 つの中で最も簡単であり、あらゆる種類の方程式のバランスを取るために適用できます。
この方法を実行する際に覚えておくべきいくつかの注意事項は次のとおりです。添字の数字を変更して方程式のバランスをとらないでください。水素原子と酸素原子を最後に残してください。1つの反応物と1つの生成物にのみ現れる元素から始めて、単一/単独分子のバランスを取ってください。
化学式のバランスを取ることは、多くの化学的性質の計算における最初のステップです。このリストには、反応における制限反応物質の検索や生成物の収率の計算などが含まれます!