
化合物の経験式または最も単純な式は、分子を構成する要素の最も単純な比率です。これらの比率は、元素記号の横の下付き文字で示されます。この問題例は、化合物の実験式を決定する手順を案内します。
例:過酸化水素の分子式は H2 です。 O2 .これは、過酸化水素1分子中に2つの水素原子と2つの酸素原子があることを意味します.これらの要素の比率は 1:1 です。分子内に存在するすべての水素原子に対して、1 つの酸素原子があります。過酸化水素の実験式はH2Oです。
問題例:
化合物のサンプルには、63.5% の銀、8.2% の窒素、および 28.3% の酸素が含まれていることがわかります。この化合物の実験式は?
解決策:
ステップ 1: サンプルが 100 グラムあるとします。これにより、指定された % 組成から、化合物中の各元素のグラム量を簡単に決定できます。
100 グラムの化合物には次のものが含まれます。
銀63.5グラム
8.2グラムの窒素
28.3 グラムの酸素
ステップ 2: これらの重量をモルに変換します。
周期表を使用して、各要素の原子量を取得します。
銀:107.87 g/mol
窒素:14.01 g/mol
酸素:16.00 g/mol
サンプル重量を原子量で割り、各元素のモル数を取得します
銀:

窒素:
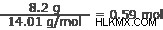
空気:
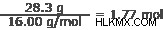
ステップ 3: これらの値の間の最小の整数比を決定します。
始めるのに最適な場所は、ほくろの最小数を見つけることです。この場合、0.59モルで銀と窒素です。各要素の量をこの数で割ります。
銀:
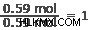
窒素:
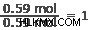
空気:
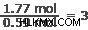
銀 1 モルに対して、窒素 1 モルと酸素 3 モルがあります。
実験式は AgNO3 です。 .
答え:
この化合物の実験式は、AgNO3 です。 .







