
純元素コバルト。 (アルケミストHP)
コバルトは周期表の原子番号 27 で、元素記号は Co です。この硬い青灰色の遷移金属は合金に使用され、ガラスに青色を与えます。特性、用途、健康への影響など、コバルトに関する事実は次のとおりです。
コバルトの事実

コバルトは原子番号 27 で、周期表の元素記号は Co です。
発見 :コバルト化合物は青銅器時代からガラスに青色を付与するために使用されてきました。スウェーデンの化学者 Georg Brandt が 1735 年頃に元素を発見しました。
名前 :元素名 コバルト ドイツ語の kobold に由来します 、これは「ゴブリン」を意味します。鉱山労働者は、製錬中に放出される有毒な蒸気と、コバルト鉱がニッケルまたは銅の製錬プロセスを台無しにする方法に言及して、コバルト鉱をコボルトと呼びました。コバルト鉱石には通常、酸化砒素が含まれており、鉱夫や精錬所を毒殺します.
プロパティ :コバルトは、鉄やニッケルに似た硬くてもろい遷移金属です。その最も一般的な酸化状態は +2 または +3 です。エレメントは磁性体で、透磁率は鉄の約 3 分の 2 です。金属は 2 つの同素体を形成します。 400°C 未満では、ベータ型が優勢です。アルファ型は、400°C を超える温度でより一般的です。コバルトの融点は 1495°C、沸点は 2870°C です。その比重は 20°C で 8.9 です。

コバルトガラスは、その色と光に敏感な液体を保護するために使用されます。 (じゅりい)
用途 :古代エジプト、ポンペイ、唐王朝、明王朝で使用されたガラスや釉薬の青色は、コバルト化合物を使用したことに由来します。今日でも、コバルト ブルーはガラスや塗料の人気のある着色剤です。
コバルトは、硬度と耐食性を追加するために合金に追加されます。磁石の製造にも使用されます。同位体コバルト 60 は、トレーサー、ガンマ線源、および放射線治療薬として使用されます。食品の殺菌にも使用されます。
同位体 :唯一の安定同位体はコバルト 59 です。 Co-50 から Co-75 までの 26 の既知の同位体があります。コバルト 60 は、研究、商業、および医療目的のための重要な放射性同位元素です。その半減期は 5.27 年です。コバルトは、コバルト爆弾として知られる一種の「汚い」爆弾の製造にも使用されます。
生物学的役割 :コバルトは人間、動物、植物の栄養にとって必須の微量元素です。ビタミン B-12 分子の一部です。ただし、鉄と同様に、コバルトへの過度の暴露は、潜在的に致命的な病状を引き起こす可能性があります.ニッケルやクロムと同様に、コバルトは皮膚に接触すると接触性皮膚炎を引き起こします。吸入すると呼吸困難を引き起こします。たばこの煙に含まれる天然成分です。 1966 年、ビールの泡を安定させるために使用されたコバルト化合物が原因で、「ビールを飲む人の心筋症」として知られる状態が発生しました。 LD50 コバルト塩の場合、150 mg/kg から 500 kg/mg の範囲です。
ソース :コバルトは超新星で r プロセスを介して形成されます。要素は多くの化合物に存在しますが、純粋な (ネイティブ) 形式では存在しません。コバルトの供給源には、鉱物のスマルタイト、エリスライト、およびコバルタイトが含まれます。コバルトは、ニッケル、銅、銀、鉄、および鉛の鉱石で発生します。この元素は多くの隕石にも見られます。
コバルト原子データ
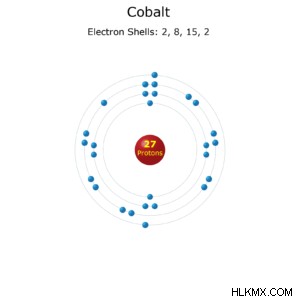
コバルト原子の電子配置。
IUPAC が承認したコバルトの周期表の日付は次のとおりです。
- 元素記号 :コ
- 原子番号 :27
- 標準原子量 :58.933194(3)
- 外見 :コバルトは、光沢のある硬い青灰色の金属です。
- グループ :グループ 9 (遷移金属)
- 期間 :ピリオド 4
- ブロック :d ブロック要素
- 電子配置 :[Ar] 3d 4s
- STP でのフェーズ :固体
- 融点 :1768 K (1495 °C, 2723 °F)
- 沸点 :3200 K (2927 °C, 5301 °F)
- 密度 :8.90 g/cm
- 酸化状態 :-3, -1, +1, +2 , +3 、+4、+5
- 電気陰性 :1.88 (ポーリング スケール)
- イオン化エネルギー :1st:760.4 kJ/mol; 2番目:1648 kJ/mol; 3位:3232kJ/mol
- 原子半径 :午後 125 時 (経験的データ)
- 結晶構造 :六方最密 (hcp)
- 発見 :ゲオルグ ブラント (1735)
参考文献
- グリーンウッド、ノーマン N.;アーンショウ、アラン (1997)。 元素の化学 (第 2 版)。バターワース・ハイネマン。 ISBN 0-08-037941-9.
- Meija, J.;ら。 (2016)。 「元素の原子量 2013 (IUPAC テクニカル レポート)」。 純粋化学と応用化学 . 88 (3):265–91. doi:10.1515/pac-2015-0305
- 数週間、メアリー・エルビラ (1932)。 「元素の発見。 III.いくつかの 18 世紀の金属」。 Journal of Chemical Education . 9:22.doi:10.1021/ed009p22







