フッ化水素酸または HF は非常に強力な腐食性の酸です。ただし、強酸ではなく弱酸に分類されます。これにより、HF は強酸 (例:HCl、HBr、HI) に分類されない唯一のハロゲン化水素酸になります。
フッ化水素酸が弱酸である理由
フッ化水素酸が弱酸である単純な理由は、水中で完全に解離しないためです (強酸の定義)。最初は、HF は実際に そう ほぼ完全に解離する:
HF + H2 O ⇆ H3 O + F
ただし、酸が解離した後は、それ自体および水との他の反応に関与します。フッ化水素酸の挙動は、水中の濃度に大きく依存します。ヒドロニウム陽イオンとフッ化物陰イオンは互いに強く引き付けられ、H3 を形成します。 O · F. この種の化学結合は酸性度を制限するのに十分強いため、フッ化水素酸は希釈溶液では非常に弱い酸です。
濃縮された HF 溶液は、強酸のように振る舞います。これは、塩基と共役酸の間に化学結合が形成されるホモ会合によるものです。
3 HF ⇆ H2 F + HF2
水素とフッ素の間の水素結合は、FHF二フッ化物イオンを安定化します。また、水素結合により、HF は他のハロゲン化水素よりも沸点が高くなります。
HF は極性ですか?
酸強度には、原子サイズと H-A 結合の極性 (A は酸) の 2 つの要因が影響します。フッ素は電気陰性度が高いため、HF の結合は極性共有結合です。結合の極性が高いほど、酸からプロトンまたは水素を除去しやすくなります。したがって、塩酸 (HCl) は臭化水素酸 (HBr) よりも強い酸です。その極性のみに基づいて、HF は HCl よりも強力であると予想されるかもしれません。しかし、HF は解離後の反応に関与し、弱酸になります!
弱いが危険
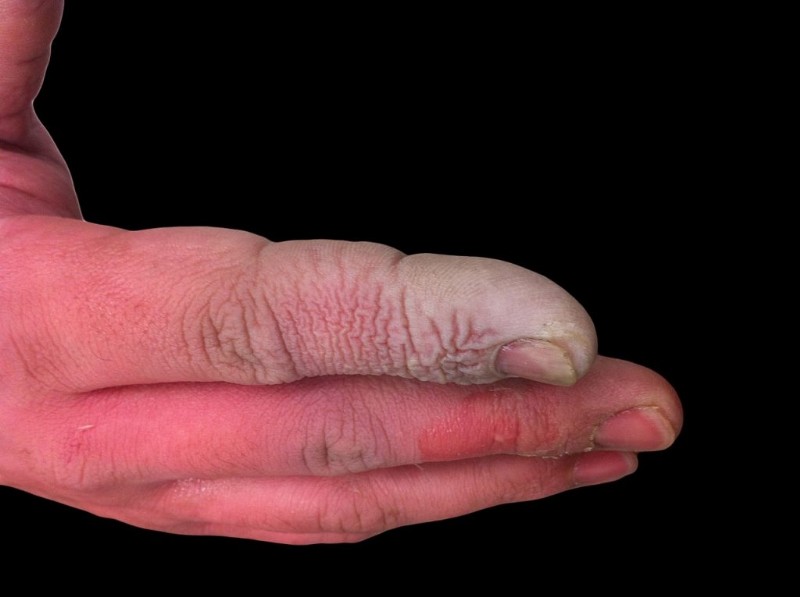
HF は弱酸ですが、非常に腐食性があります。希薄な溶液でもガラスを侵すため、プラスチック容器に保管する必要があります。いくつかの理由で作業するのは危険です。第一に、HF は神経機能を妨害するため、他の酸の場合のように露出してもすぐに痛みを感じることはありません。第二に、組織から吸収されるため、皮膚や粘膜に化学火傷を引き起こすだけではありません.最終的に、酸は組織の奥深くまで働きかけ、骨の損傷と肺への体液の蓄積を引き起こします。フッ化水素酸によるやけどは深刻ではないように見えるかもしれませんが、すぐに対処する必要があります。
参考文献
- ファーヴル、アンリ A.;パウエル、ウォーレン H.、編。 (2014)。 有機化学の命名法:IUPAC 勧告および優先名 2013 .ケンブリッジ:王立化学会。 ISBN 9781849733069.
- ジゲール、ポール A.;タレル、シルビア(1980)。 「フッ化水素酸の性質。プロトン移動錯体 H3 の分光学的研究 の"。 J.午前。化学。社会 . 102 (17):5473. doi:10.1021/ja00537a008
- プルキッチ、アンテ。 Giljanović、ヨシパ。ブラリッチ、マリヤ。ボバン、カタリナ(2012)。 「イオン選択性フッ化物電極を使用したフッ化物種の直接電位差測定」。 Int. J.Electrochem.科学 . 7:1170–1179.