現代の周期表の人気は、それが使いやすいリファレンスであることから来ています。この表は、化学の研究を簡素化しています。元素の周期表を覚えることで、それらの物理的および化学的性質をたどることができます。元素によって形成される化合物に関する予測は、テーブル内の位置に基づいて決定されます。
周期表の現在形
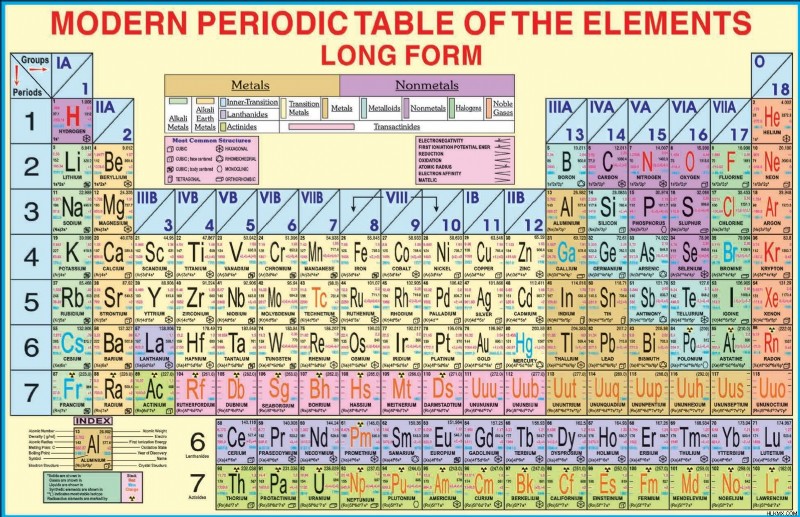
元素の周期表では、表形式を使用して発見された化学元素を表します。この表では、要素は行 (ピリオド) と列 (グループ) の下に原子番号の昇順で配置されています。
ロシアの化学者で発明家のドミトリー メンデレーエフは、1869 年に現代の周期表の最初のバージョンを発表しました。周期表は、化学と物理学における数十年にわたる科学的発展を反映して進化してきました。現在、科学における最も重要な成果は、現代の周期表です。この表は、縦に 18 列、横に 7 行、118 の要素で構成されています。
現代の周期表の周期傾向とは?
元素のさまざまな側面を示す周期表の特定のパターンは、周期的な傾向の範囲です。これには、要素のサイズと電子特性が含まれます。これらの傾向は、元素間の類似した原子構造とそれらの周期的性質に起因します。
周期表の周期的な傾向を紹介しましょう:
· 電気陰性度の傾向:
電子を引き付けて結合する能力を表す原子の化学的性質は、電気陰性度として定義されます。ただし、定性的な特性のため、電気陰性度を計算するための標準的な方法はありません。
化学結合を形成する過程で、特定の化学元素の原子が共有電子を引き寄せる傾向が、電気陰性度を定義します。 Linus Pauling は 1932 年に電気陰性度の概念を導入しました。ポーリング スケールは、結合のエネルギーと電気陰性度の関係を説明します。
一定期間にわたって、左から右に電気陰性度が増加します。ただし、これとは逆に、グループを下に移動すると同じ値が減少します。前者は、左から右に移動するときに電子遮蔽に比べて核電荷が急速に増加するために発生します。
· 電子親和力の傾向:
原子が気相中の中性原子から電子を受け取る能力は、電子親和力として定義できるものです。
原子または分子の電子親和力は、電子が気体状態の中性原子または分子に結合して陰イオンを形成するたびに放出されるエネルギー量と関係があります。
電子親和力の値が負であるほど、電子に対する原子の親和力が高くなります。電子親和力は、電子が中性ガス原子に追加されたときに発生するエネルギー変化を示すために定量的に測定できます。
電子親和力は、周期表の左から右に増加することを知っておく必要があります.
原子半径の減少が原因です。同様に、電子親和力はグループ内で上から下に減少します。繰り返しますが、これは原子半径の増加の結果です.
· イオン化エネルギーの傾向:
イオン化エネルギーの傾向は、孤立した原子または分子から電子を除去するために必要なエネルギーに関連しています。グループを下に移動すると、イオン化エネルギーが減少します。これは、電子遮蔽のために起こります。ただし、周期表上で左から右に移動すると、イオン化エネルギーが増加します。これは原子価殻の安定性の結果です。
希ガスは完全な原子価殻を持っています。これの直接的な結果は、それらが高いイオン化エネルギーを保持することです。周期表のすべての元素を考慮すると、イオン化エネルギーが最も高いのはヘリウムです。
· 原子半径の傾向:
2 つの原子の原子核間の距離の半分が原子半径です。ただし、すべての原子が同じ方法で結合しているわけではないため、複雑さが生じます。
原子半径は、周期内で左から右に減少します。これは、ある期間にわたって陽子と電子の数が増加するためです。陽子は電子よりも大きな効果があります。その結果、電子が原子核に引き寄せられ、半径が小さくなります。
一方、原子半径はグループの上から下に向かって増加します。
·融点の傾向:
元素の融点は、元素の状態を固体から液体に変化させるのに必要なエネルギーとして説明できます。したがって、原子間の結合が強いほど、融点が高くなります。
融点はさまざまであるため、周期表全体で区別できる傾向を形成しません。ただし、独特のパターンが見られます。
金属の場合、高い融点が予測されます。非金属はより低い融点を持っています。すべてのケースに例外があることはわかっています。
非金属である炭素は、すべての元素の中で最も高い融点を持っています。また、半金属ホウ素は融点が高いです。
・メタリック文字のトレンド:
元素の金属特性は、原子が電子を失う準備が整っていることと関係があります。期間を超えて左から右に、メタリックな特性が減少します。これは、原子の半径が小さくなり、外側の電子がより容易にイオン化できるようになるためです。
同様に、メタリックな特性はグループの下に向かって増加します。電子シールドにより原子半径が増加します。金属の性質は、電子を失う能力と関係があります。これとは反対に、非金属性は電子を獲得する能力に関連しています。
結論:
現代の周期表の人気は、それが使いやすいリファレンスであることから来ています。この表は、化学の研究を簡素化しています。元素の周期表を覚えることで、それらの物理的および化学的性質をたどることができます。元素によって形成される化合物に関する予測は、テーブル内の位置に基づいて決定されます。
この表は豊富な情報源として機能します。さらに、さまざまな要素間の関係についての詳細を強調しています。