ディプロティック 酸は、水溶液中の分子あたり 2 つの水素イオン (H) または陽子を供与できる酸です。二塩基酸の別名は二塩基酸です。二塩基酸は多塩基酸の一種で、1 分子あたり複数のプロトンを供与できる酸です。対照的に、モノプロトン酸は、水中で 1 つのプロトンまたは水素のみを供与します。
ジプロトン酸の例
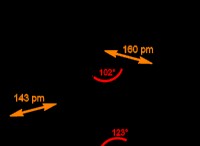
二塩基酸の例としては、硫酸 (H
ジプロトン酸の働き
学生は一般に、ジプロトン酸は常にプロトンまたは水素イオンの両方を失うと想定しています。ただし、最初と 2 番目の陽子の損失のしやすさは通常非常に異なるため、これは当てはまりません。 最初の酸解離定数 K
たとえば、硫酸は最初の陽子を簡単に失います (K
H2 SO4 (aq ) + H2 O(l ) → H3 O(aq ) + HSO4 (aq ) [K
K
HSO4 (aq ) + H2 O(l ) ↔ H3 O(aq ) + SO4 (aq ) [K
実際には、硫酸はアンモニアなどの塩基と反応すると、両方の水素原子を完全に脱プロトン化するか、または失います。
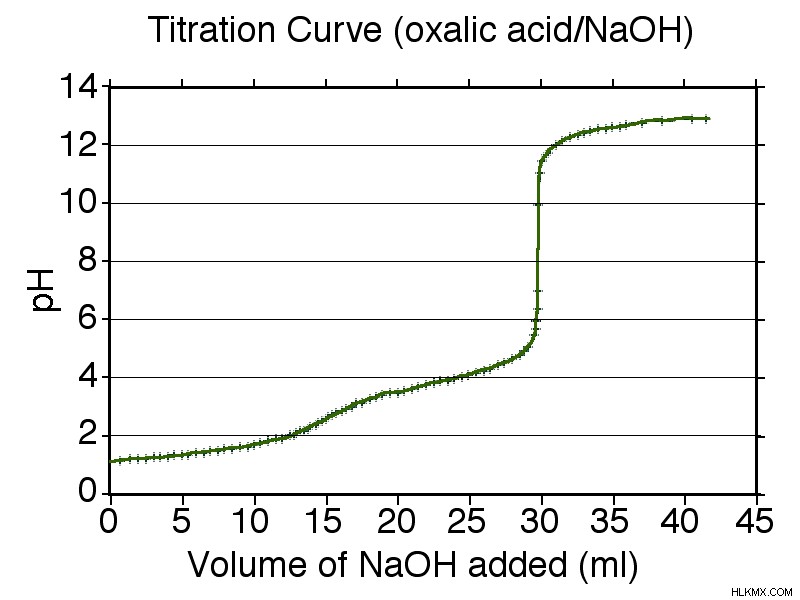
ジプロトン酸滴定曲線
滴定は、酸解離定数を計算するために使用されます。モノプロトン酸の場合、滴定曲線の始点と当量点の中間にある点の pH を使用して、Henderson-Hasselbalch 式を使用して pKa 値を求めます。
pH =pKa + log ([塩基]/[酸]
pH =pKa + ログ (1)
pH =pKa
二塩基酸の場合、一塩基酸と同じ方法で最初の酸解離定数を求めることができます。 2 番目の酸解離定数は、1 番目の当量点と 2 番目の当量点の中間点です。
参考文献
- エビング、ダレル。ギャモン、スティーブン D. (2016 年 1 月 1 日)。 一般化学 .センゲージ学習。 ISBN 9781305887299.
- ジェイムソン、レジナルド F. (1978). 「3-(3,4-ジヒドロキシフェニル)アラニン(L-ドーパ)のプロトン会合定数の割り当て」。 Journal of the Chemical Society .ダルトン・トランザクション。 0 (1):43–45. doi:10.1039/DT9780000043
- Petrucci R.H., Harwood, R.S.;ニシン、F.G. (2002)。 一般化学 (第8版)。プレンティスホール。 ISBN 0-13-014329-4.
- Skoog, D.A.;ウェスト、DM;ホラー、J.F.; Crouch, S.R. (2004)。 分析化学の基礎 (第8版)。トムソン・ブルックス/コール。 ISBN 0-03-035523-0.