CoCl2 (ホスゲンガス) などの分子の形式電荷を決定する場合、各原子の価電子数と分子のルイス構造を知る必要があります。
価電子数
<オール>元素の周期表で各原子を調べて、価電子の数を決定します。
2 つの電子が最初の s シェルに、2 つの電子が 2 番目の s シェルに、6 つの電子が最初の p シェルに、というように覚えておいてください。 ^2)3p(^6)
充電調整します。分子がイオンの場合、最終的な電荷を考慮して、全体で 1 つまたは複数の電子を追加または削除します。
CoCl2 (ホスゲンガス) の場合:C =4; O =6; Cl =7. 分子はイオン化されておらず、中性の電荷を持っています。したがって、価電子の総量は 4 + 6 + (7x2) =24 です。
ルイス構造
<オール>CoCl2 (ホスゲンガス) のルイス構造の図を参照してください。ルイス構造は、分子の最も安定でありそうな構造を表します。原子は対になった価電子で描画されます。オクテット規則を満たすために、孤立電子間に結合が形成されます。
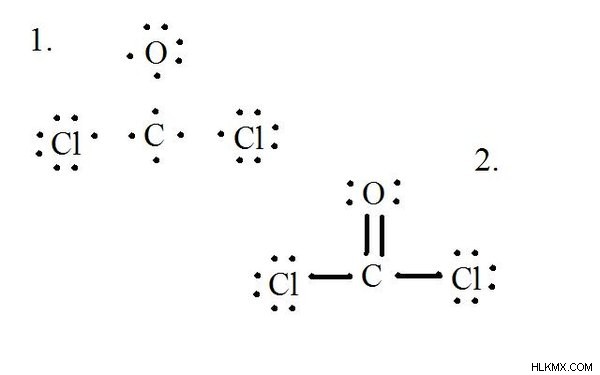
各原子とその価電子を描画し、必要に応じて結合を形成します。
塩化物原子は炭素分子と単結合を共有していますが、酸素原子は炭素と二重結合を形成しています。最終構造の各原子はオクテット規則を満たし、分子の安定性を可能にする 8 つの価電子を持っています。
各原子の形式電荷
<オール>ルイス構造の各原子の孤立電子対を数えます。各原子に、それが関与する各結合から 1 つの電子を割り当てます。これらの数字を合計します。 CoCl2 では、C =0 個の孤立電子対と結合からの 4 個の電子 =4 個の電子。 O =孤立電子対からの 4 電子 + 結合からの 2 電子 =6 電子。 Cl =孤立電子対からの 6 個の電子 + C との結合からの 1 個の電子 =7 個の電子。
結合していない原子の価電子の数から合計を引きます。結果は、その原子の正式な電荷です。 CoCl2 の場合:C =非結合原子の 4 価電子 (v.e.) - ルイス構造の 4 つの割り当てられた電子 (L.s.) =0 形式電荷 O =6 v.e. - 6 L.s. =0 形式電荷 Cl =7 v.e. - 7 L.s. =0 正式料金
これらの電荷をルイス構造の原子の隣に書きます。分子全体に電荷がある場合は、ルイス構造を角かっこで囲み、右上隅の角かっこの外側に電荷を書きます。
警告
-
遷移金属を含む分子の形式電荷の計算は難しい場合があります。遷移金属の価電子の数は、希ガスのようなコアの外側のものになります。