極性分子と非極性分子は、分子の 2 つの広いクラスです。極性は、分子の周囲の電荷の分布を表します。電荷は非極性分子では均一に分布していますが、極性分子では不均一に分布しています。つまり、極性分子には部分電荷の領域があります。
極性分子と非極性分子の例、極性がイオン結合と共有結合にどのように関係しているか、極性を使用してどの分子が混合するかを予測する方法について説明します。
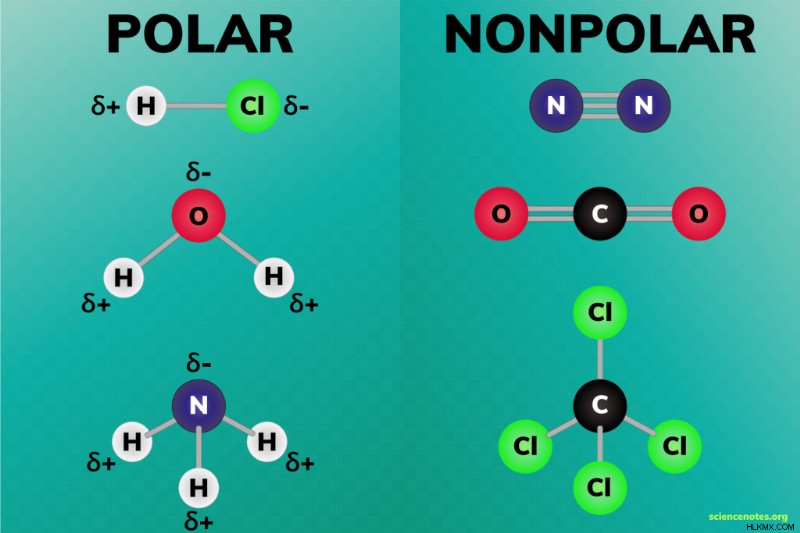
- 同じ電気陰性度を持つ 2 つの非金属間に無極性結合が形成されます。
- 極性結合は、電気陰性度の値が異なる元素の原子間に形成されます。
- 無極性分子にはあらゆる種類の化学結合が含まれる可能性がありますが、部分電荷は互いに打ち消し合います。
- 極性分子には極性の共有結合またはイオン結合が含まれており、それらの部分電荷が互いに相殺されないように配置されています。
極性および無極性の化学結合
極性および非極性の化学結合を理解し、識別することで、極性分子の理解が容易になります。極性結合では、一方の原子は部分的に正の電荷を持ち、もう一方の原子は部分的に負の電荷を持ちます。言い換えれば、極性結合は電気双極子を形成します。無極性結合では、原子は電子を均等に共有するため、原子間に部分的な正または負の電荷はありません。原子が極性結合を形成するか非極性結合を形成するかは、それらの電気陰性度の値の違いに依存します。
- 無極性結合 :電気陰性度が同一の 2 つの原子間で無極性結合が形成されます。このタイプの結合は、純粋な共有結合です。たとえば、2 つの水素原子は非極性結合を形成します。
- 極性結合 :2 つの原子間の電気陰性度の値が近いが同じでない場合、原子は極性共有結合を形成します。極性共有結合は、2 つの異なる非金属間に形成されます。たとえば、水素 (電気陰性度 =2.1) と塩素 (電気陰性度 =3.0) は極性共有結合を形成します。電気陰性度の値が大きく異なる場合、原子はイオン結合と呼ばれる極性結合を形成します。金属と非金属の間にイオン結合が形成されます。
最も極性の高い結合はイオン結合です。極性共有結合はわずかに極性があります。純粋な共有結合は無極性です。
極性分子
極性分子には双極子があり、分子の一部は部分的に正電荷を持ち、一部は部分的に負電荷を持っています。二原子イオンおよび極性共有結合分子は極性分子です。しかし、2 つ以上の原子を含む分子も極性を持つことができます。極性分子は、非対称の形状、孤立電子対、または異なる電気陰性度値を持つ他の原子に結合した中心原子を持っています。通常、極性分子にはイオン結合または極性共有結合が含まれています。極性分子の例:
- 水 – H2 ああ
- アンモニア – NH3
- 二酸化硫黄 – SO2
- 硫化水素 – H2 S
- 一酸化炭素 – CO
- オゾン – O3
- フッ化水素酸 – HF (および単一の H を持つ他の分子)
- エタノール – C2 H6 O (および一端が OH の他のアルコール)
- スクロース – C12 H22 O11 (および OH 基を持つその他の糖)
極性分子は、多くの場合、親水性であり、極性溶媒に溶解します。極性分子は、多くの場合、同様のモル質量を持つ非極性分子よりも融点が高くなります。これは、水素結合などの極性分子間の分子間力によるものです。
非極性分子
非極性分子は、電子が分子内の原子間で均等に共有される場合、または分子内の電子の配置が対称的で双極子電荷が互いに打ち消し合う場合に形成されます。非極性分子の例:
- いずれかの希ガス:He、Ne、Ar、Kr、Xe (ただし、技術的にはこれらは原子であり、分子ではありません)
- 等核二原子元素のいずれか:H2 , N2 、O2 、Cl2 (これらは真に非極性分子です。)
- 二酸化炭素 – CO2
- 三フッ化ホウ素 – BF3
- ベンゼン – C6 H6
- 四塩化炭素 – CCl4
- メタン – CH4
- エチレン – C2 H4
- ガソリンやトルエンなどの炭化水素系液体
- 例外 (アルコールや糖など) を除くほとんどの有機分子
非極性分子には、いくつかの共通の特性があります。それらは室温で水に不溶で、疎水性で、他の非極性化合物を溶解できる傾向があります。
極性結合を持つ非極性分子
極性は、化学結合を形成する 2 つの原子間の相対的な電気陰性度の値に依存します。同じ電気陰性度の値を持つ 2 つの原子が共有結合を形成します。電子は共有結合の原子間で均等に共有されるため、結合は無極性です。電気陰性度の値がわずかに異なる原子は、極性共有結合を形成します。原子間の電気陰性度の値が大きく異なる場合、イオン結合が形成されます。イオン結合は極性が高いです。
多くの場合、結合の極性は分子の極性と同じです。ただし、極性結合を持つ非極性分子と非極性結合を持つ極性分子があります。たとえば、三フッ化ホウ素は、極性共有結合を含む非極性分子です。 BF3 は、ホウ素原子とフッ素原子の間の結合が極性であるにもかかわらず、分子の周りに電荷を均等に分配する三方晶平面分子です。オゾンは、非極性の共有結合でできた極性分子の例です。 O3 中の酸素分子間の化学結合 原子は同じ電気陰性度の値を持っているため、純粋に共有結合です。ただし、オゾン分子は (水のように) 曲がった形をしており、その電子は 3 つの原子すべてと同じ時間を過ごすことはありません。中央の原子には部分的に正の電荷があり、外側の 2 つの原子にはそれぞれ部分的に負の電荷があります。
極性と混和性
極性を使用して、2 つの化合物が混和する (混合して溶液を形成する) かどうかを予測できます。経験則は、「似たようなものは似たように溶ける」というものです。これが意味することは、極性溶媒は極性溶質を溶解し、非極性溶媒は非極性溶質を溶解するということです.これは、アルコールと水が完全に混和する理由 (両方とも極性) と、油と水が混ざらない理由 (非極性と極性) を説明しています。
ある分子と別の分子の間の中間の極性を持つ化合物は、通常は不溶性である化学物質を溶媒に溶解するための仲介者として機能することができます.たとえば、イオン性化合物または極性化合物を有機無極性溶媒に混合するには、最初にエタノールに溶解します。エタノールの極性はわずかですが、多くの場合、溶質を溶解するには十分です。極性分子が溶解したら、エタノール溶液をキシレンやベンゼンなどの非極性有機溶媒に混ぜます。
参考文献
- Ingold, C.K.;インゴールド、E.H. (1926)。 「炭素鎖における交番効果の性質。パート V. 極性および非極性解離のそれぞれの役割に特に言及した芳香族置換の議論。酸素と窒素の相対指令効率のさらなる研究」。 J.化学。社会 .:1310–1328。 doi:10.1039/jr9262901310
- マック、ケネス M.; Muenter、JS (1977)。 「分子線分光法によるオゾンのシュタルクおよびゼーマン特性」。 Journal of Chemical Physics . 66 (12):5278–5283。 doi:10.1063/1.433909
- ポーリング、L. (1960)。 化学結合の性質 (第3版)。オックスフォード大学出版局。 ISBN 0801403332.
- Ziaei-Moayyed、マリアム。グッドマン、エドワード。ウィリアムズ、ピーター (2000 年 11 月 1 日)。 「極性液体ストリームの電気的たわみ:誤解されたデモンストレーション」。 Journal of Chemical Education . 77 (11):1520. doi:10.1021/ed077p1520