Lewis 構造は、1916 年にこの概念を開発した Gilbert N. Lewis にちなんで名付けられました。このアイデアは、後に 1920 年に Irving Langmuir によって導入され、命名されました。ルイス構造は、電子ドット構造としても知られています。ルイスは、原子間の結合と原子上のドットで表される価電子を表す簡単な表記法を導入しました。これらの表記法は、ルイス記号またはルイス ドット構造と呼ばれます。
第 2 ピリオド要素のルイス記号は

一部の陰イオンのルイス記号は

ルイス線図の描き方
窒素原子には 5 つの価電子があり、完全なオクテットを達成するにはさらに 3 つの電子が必要であることがチャートからわかります。酸素原子には 6 つの価電子があり、完全なオクテットを完成させるにはさらに 2 つの電子が必要であることがわかっています。チャートから、窒素は 3 つの価電子を放棄し、酸素は 2 つの原子間に三重結合を形成することによって 2 つの価電子を獲得することがわかります。
NO3- のルイス構造を描いてみましょう。まず、分子内の価電子の数を計算する必要があります。すべての原子のグループ番号とその電荷を追加することで計算できます。その後、価電子の数を取得します。
N(価殻電子=5)
O (*3) 18
チャージ 1
合計:24
オクテット規則では、中心原子の外殻に 8 つの電子が必要です。結合を形成する前に電子を使い果たした場合、それを完了するために複数の結合を作成する必要があります。複数の結合の数は、扱っている元素の種類によって異なります。ここで、N が電子とショートしていることがわかります。ここで、左側にある O の原子から孤立電子対を 1 つ使用できます。したがって、酸素の 1 つと二重結合を形成し、結合を完成させるのに役立ちます。
次に、分子の形式電荷を決定する必要があります。分子内の各原子の形式電荷は、分子の極性と結合の方向を示すため、重要です。正の形式電荷を持つすべての原子は求電子剤であり、通常は求電子付加反応の攻撃種です。負の形式電荷 (マイナス記号で示される) を持つ原子は求核剤であり、伝統的に求核置換反応における攻撃種です。
正式な請求なしにルイス構造を完成させることはできません。これに必要なものは次のとおりです:
形式電荷が原子の電気陰性度と同じである必要があります。これは、電気陰性原子の負電荷が多く、電気陰性原子の正電荷が少ないことを意味します。
形式電荷は、すべての結合が完全にイオン性である場合の電荷です。 -1 と +1 の電荷が近くにある場合、それらの電荷が相殺されるように並べ替えることができます。これを行う 1 つの方法は、-1 原子の孤立電子対を使用して、最も近い +1 原子と二重結合を形成することです。これにより、それらの間に単結合ではなく二重結合が形成され、正味の電荷はなくなります。
NO3- のルイス構造:
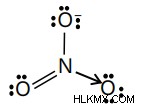
窒素と酸素の 1 つ (赤で表示) の間の二重結合が「最良の」構造であると判断しました。それは問題ありませんが、この情報を表示するにはいくつかの方法があります。
コッセル・ルイス理論の仮定
Kossel は化学結合に関するいくつかの事実を議論しており、重要な仮定は次のとおりです:
1.電気陰性度の高いハロゲンは、電気陽性度の高いアルカリ金属とともに、周期表の下で利用可能な希ガスによって分離されているようです.
2.ハロゲンからの負イオンとアルカリ金属からの正イオンの生成は、電子の獲得と喪失に関連しています。
3.正イオンと負イオンは、希ガス配置の安定した電子配置を作ります。
4.周期表の各希ガスは、デュプレット配置を構成するヘリウムを除いて、オクテットの安定した電子配置を持っています。
例:NaCl、NaNaCl の形成を考えると、Na は電子を失い、それは塩素によって得られます。電子を失うことにより、NaNa はネオンの安定した構成を達成し、ClCl は電子を得るとアルゴンの安定した構成を達成します。
ナ → Na++1e–
[Ne]3s1 [Ne]
Cl+1e– → Cl1-
[Ne]3s23p5 [Ar]
結論:
記号を囲むドットの数は、利用可能な価電子の数を示します。これは、特定の元素の標準またはグループ価を計算するのに役立ちます.
ルイス構造の概念によれば、異なる元素に関連する原子が積極的に結合して八重項 (最も外側の原子価殻に 8 個の電子) または二重項 (外側に 2 個の価電子) を完成させます。原子価殻 ) 最も近い希ガス配置を達成するため。この完全なプロセスは OCTET RULE として知られています。