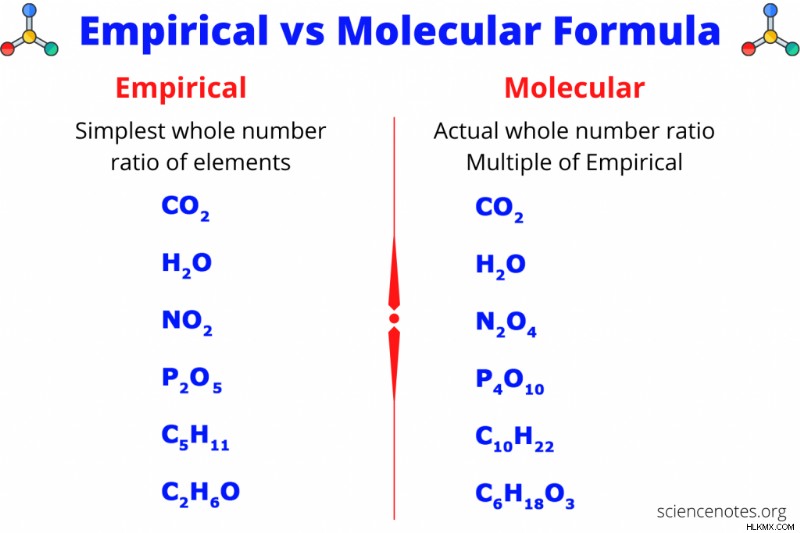
実験式と分子式は、化合物中の元素の比率または割合を示す 2 種類の化学式です。経験的または最も単純な式は、化合物中の元素の最小の整数比を示し、分子式は元素の実際の整数比を示します。分子式は経験式の倍数ですが、経験式に「1」を掛けることもありますが、2 つの式は同じです。燃焼や組成分析では必ず経験式が出てきますが、分子量がわかれば分子式を求めることができます。以下は、実験的および分子式の例と、質量パーセントと分子量からこれらの式を見つける方法を示す実際の問題です。
経験式
実験式は、化合物の最も単純な式です。式内のすべての下付き文字を最小公約数で割ることにより、分子式から経験式を得ることができます。たとえば、分子式が H2 の場合 O2 の場合、最小公分母は 2 です。両方の添字を 2 で割ると、HO の最も単純な式が得られます。分子式がC6の場合 H12 O6 の場合、最小公約数は 6 で、最も単純な式は CH2 です。 O. 分子式が CO2 の場合 の場合、最小公分母は 1 であり、実験式は分子式と同じです。
分子式
分子式は、化合物の実際の式です。実験式と同様に、添字は常に正の整数です。分子式は経験式の倍数です。たとえば、ヘキサンの実験式は C3 です。 H7 、分子式はC6 H14 .分子式を取得するために、実験式の両方の下付き文字に 2 を掛けました。
経験式と分子式
以下は、経験的式と分子式の簡単な比較です:
| 経験式 | 分子式 |
| 化合物の最も単純な元素組成 | 化合物の実際の元素組成 |
| 化合物中の元素の質量パーセントから発見 | 実験式と化合物の分子量を使用して発見 |
| 要素の単純な整数比 | 整数比のままの経験式の倍数 |
| 燃焼または組成分析から発見 | 化学反応を書き、構造式を描く |
経験式から分子式を求める手順
分子式は実験式と分子量から求めることができます。
例
たとえば、実験式が C3 であることを知っているヘキサンの分子式を見つけてみましょう。 H7 その分子量は 86.2 amu.
まず、分子の式量を計算します。これを行うには、各元素の原子量を調べ、それぞれに実験式の添え字を掛けてから、すべての値を合計して式の量を取得します。
カーボン:12.01×3=36.03
水素:1.008 x 7 =7.056
式の重量 =36.03 + 7.056 =43.09 amu
これで、分子式は経験式の倍数でなければならないことがわかりました。分子量を経験値で割って、分子量と式量の比率を求めます:
分子量 / 実験量 =86.2 / 43.09 =2
多くの場合、10 進数の値を取得しますが、整数に近い値にする必要があります。最後に、実験式の各添字にこの整数を掛けて、分子式を取得します。
C3×2 強7×2 =C6 H14
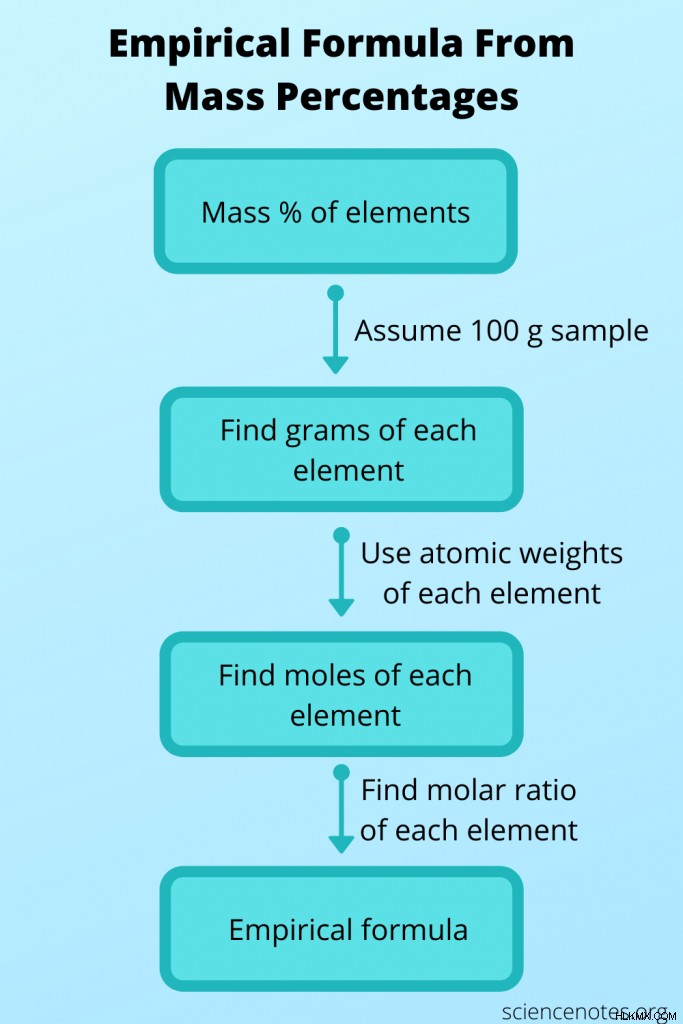
経験式がわからない場合もありますが、他のデータから決定し、それを使用して分子式を取得できます。この場合、化合物の分子量と各原子の質量百分率から分子式を求めます。これを行うには、次の手順に従います。
<オール>例
たとえば、分子量が 176 amu で、サンプルの質量が C 40.92%、H 4.58%、O 54.50% の場合、アスコルビン酸 (ビタミン C) の実験式と分子式を求めます。
まず、100 グラムのサンプルがあると仮定します。これにより、各要素の質量が決まります:
- 40.92 g C
- H4.58 g
- 54.50 g O
次に、これらの元素の原子量を調べて、各元素の分子数を調べます。このステップがよくわからない場合は、グラムをモルに変換する方法を確認してください。
- mol C =40.92 g x (1 mol/12.011 g) =3.407 mol C
- mol H =4.58 g x (1 mol/1.008 g) =4.544 mol H
- mol O =54.50 g x (1 mol/15.999 g) =3.406 mol O
各モル値を最小のもの (この例では 3.406) で割って、要素間の最も単純な整数比を見つけます。 「1.5」、「1.333」、「1.667」などの小数値に注意してください。これらは、整数値を取得するために使用できる分数を示しているためです。
- C =3.407 mol / 3.406 mol =1.0
- H =4.544 mol / 3.406 mol =1.334
- O =3.406 mol / 3.406 mol =1.0
実験式の下付き文字は整数である必要がありますが、水素は分数です。整数を得るには、何を掛ける必要があるかを自問する必要があります。 「.33」は 1/3 の 10 進数値であるため、すべての数値に 3 を掛けて整数を取得できます。
- C =1.0 x 3 =3
- H =1.333 x 3 =4
- O =1.0 x 3 =3
これらの値を添え字として代入すると、実験式が得られます:
C3 H4 O3
分子式を見つけるには、まず各下付き文字にその原子の原子量を掛け、すべての値を合計して実験式の質量を決定します。
(3 x 12.011) + (4 x 1.008) + (3 x 15.999) =88.062 amu
この値がサンプルの分子量とほぼ同じであれば、分子式は実験式と同じです。 88.062 は 176 とは異なるため、分子式が実験式の倍数であることがわかります。分子量を実験式の重みで割って乗数を求めます:
176 amu / 88.062 amu =2.0
最後に、実験式の各添字にこの数値を掛けて、分子式を取得します。
アスコルビン酸の分子式 =C3×2 H4×2 O3×2 =C6 H8 O6
構造式
実験式と分子式は、化合物内の原子の種類と数を示していますが、それらの原子がどのように配置されているかはわかりません.構造式は、単結合、二重結合、三重結合、環、および場合によっては三次元構造を示します。構造式の種類には、ルイス構造、骨格式、ニューマン射影、ソーホース射影、ハワース射影、およびフィッシャー射影が含まれます。
参考文献
- バロウズ、アンドリュー。 (2013)。 化学:無機化学、有機化学、物理化学の紹介 (第 2 版)。オックスフォード。 ISBN 978-0-19-969185-2.
- ペトルッチ、ラルフ H.;ハーウッド、ウィリアム・S。 Herring, F. Geoffrey (2002)。 一般化学:原理と最新の応用 (第8版)。ニュージャージー州アッパーサドルリバー:プレンティスホール。 ISBN 978-0-13-014329-7.







