質量数、原子質量、および原子番号は、化学における 3 つの関連概念です。
- 原子番号 要素の原子の陽子の数です。これは、一般的な表記法では整数または記号 Z です。元素記号がわかれば陽子の数がわかるので、必ず記載しているわけではありません。
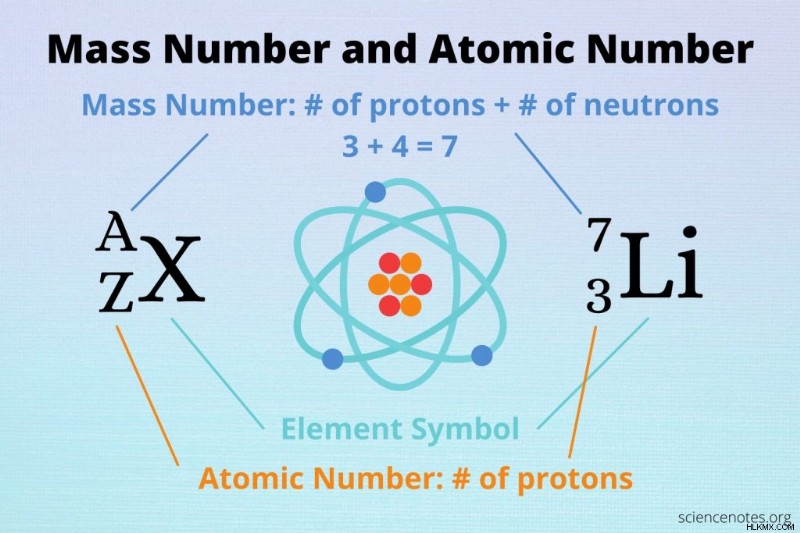
- 質量数 原子中の陽子と中性子の数の合計です。つまり、原子中の核子の数です。質量数も整数であり、一般的な表記では記号 A を使用します。要素記号の右上または左上に表示されます。
- 原子量 (原子量) は 平均 元素のサンプル中の陽子と中性子の数。これは、元素の同位体の自然存在量に基づいて計算された数値であるため、整数である必要はありません。たとえば、ヘリウムの原子質量は 4 ではなく 4.003 です。
原子質量と質量数
原子質量と質量数はどちらも、サンプル内の陽子と中性子の数を反映しています。違いは、周期表の原子質量は、元素の自然発生サンプルのすべての同位体の平均質量であることです。対照的に、質量数は、元素の単一原子の陽子と中性子の数です。たとえば、3 の質量数 Li は 7 ですが、リチウムの原子質量は 6.941 です。これは、天然リチウムの一部の原子の質量数が 7 未満であることを示しています。
原子番号と質量数の例
原子番号は要素のアイデンティティです。元素の周期表には、原子番号の増加に従って元素がリストされています。水素は原子番号 1、ヘリウムは原子番号 2、というように、原子番号 118 のオガネソンに到達するまで続きます。表では、原子番号は元素タイルに記載されている整数です。
同位体表記で原子番号が表示される場合もあれば、質量数のみが表示される場合もあります。たとえば、2 では H は質量数が 4 で原子番号が 2 です。質量数は He で 4 です。質量数を書く別の方法は、元素記号に従うことです。たとえば、He-4 と He-3 は、ヘリウムの 2 つの同位体を示します。最初の質量数は 4 で、2 番目の質量数は 3 です。
ヒント:数字が 2 つある場合、小さい方が質量数、大きい方が質量数です。
どの元素同位体でも原子番号は変わりません。中性子の数が同位体を決定するため、質量数のみが変化します。
原子番号、原子質量、質量数が同じ場合が 1 つあります。これは、プロチウムと呼ばれる水素の同位体の純粋なサンプルです。プロチウムには、陽子が 1 つあり、中性子はありません。数字はすべて「1」です。
陽子と中性子の数を求める
質量数と、原子番号または元素記号のいずれかを使用して、原子内の陽子と中性子の数を決定できます。
例:6 の陽子と中性子の数を求めます。 C (カーボン 14 とも呼ばれます)。
大きい方の数は、陽子と中性子の合計です。陽子の数または原子番号は 6 です。これは、表記法から、または周期表で炭素の原子番号を調べることによって得られます。中性子の数を得るには、質量数から陽子の数を引きます:
中性子の数 =質量数 – 原子番号
中性子の数 =14 – 6
中性子の数 =8
陽子の数は原子番号 6 です。
参考文献
- ビショップ、マーク。 「物質と化学元素の構造」。 化学の紹介 .キラル出版。 ISBN 978-0-9778105-4-3.
- ジェンセン、ウィリアム B. (2005). 「原子の重さと数を表す記号 A と Z の起源」。 J.化学。教育 82:1764.







