主な違い – エンタルピーと内部エネルギー
エネルギーは、システムとその周囲の間で異なる方法で交換できます。エンタルピーと内部エネルギーは、このエネルギー交換を説明するために使用される熱力学的用語です。エンタルピーは、内部エネルギー タイプの合計です。内部エネルギーは、位置エネルギーまたは運動エネルギーのいずれかです。エンタルピーと内部エネルギーの主な違いは、エンタルピーは、システム内で発生する化学反応中に吸収または発生した熱です。 一方、内部エネルギーは、システム内の位置エネルギーと運動エネルギーの合計です。
対象となる主な分野
1.エンタルピーとは
– 定義、単位、計算式、プロパティ、例
2.内部エネルギーとは
– 定義、計算式、プロパティ、例
3.エンタルピーと内部エネルギーの違いは何ですか
– 主な違いの比較
重要な用語:エンタルピー、熱、内部エネルギー、融解熱、蒸発熱ジュール、運動エネルギー、位置エネルギー、システム、熱力学

エンタルピーとは
エンタルピーは、化学反応の進行中に吸収または発生する熱エネルギーです。エンタルピーには記号 H が与えられます。H はエネルギー量を示します。エンタルピーの変化は ΔH として与えられ、記号 Δ はエンタルピーの変化を示します。エンタルピーはジュール (j) またはキロジュール (kj) で与えられます .
エンタルピーはシステムの内部エネルギーの合計であると言えます。これは、化学反応中に内部エネルギーが変化し、この変化がエンタルピーとして測定されるためです。一定の圧力で発生するプロセスのエンタルピーは、次のように与えられます。
H =U + PV
どこで、
H はエンタルピー、
U 内部エネルギーの合計です
P システムの圧力
V システムのボリュームです
したがって、エンタルピーは、実際には、内部エネルギーと、システムの体積を特定の圧力で維持するために必要なエネルギーの合計です。 「PV」という用語は、システムのスペースを確保するために環境で実行する必要がある作業を示します。
エンタルピー変化は、特定の反応が吸熱反応か発熱反応かを示します。 ΔH の値が正の値の場合、反応は吸熱反応です。つまり、反応が起こるためには、外部からそのシステムにエネルギーを与える必要があります。しかし、ΔH が負の値の場合、反応が外部にエネルギーを放出していることを示します。
さらに、物質の相変化や状態変化にはエンタルピー変化が生じます。たとえば、固体が液体に変換されると、エンタルピーが変化します。これは融解熱と呼ばれます .液体が気体に変換されるときのエンタルピー変化は、気化熱と呼ばれます。 .
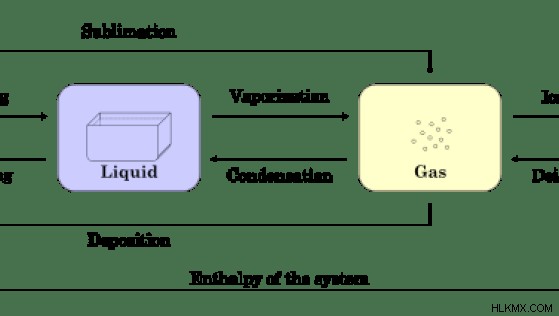
図 01:物質の状態または相の変化
上の画像は、システム内の物質の状態または相の変化を示しています。ここで、すべての遷移には独自のエンタルピーがあり、その反応が吸熱反応か発熱反応かを示します。
系の温度はエンタルピーに大きな影響を与えます。上記の式によると、内部エネルギーが変化するとエンタルピーが変化します。温度が上昇すると、分子の運動エネルギーが増加するため、内部エネルギーが増加します。次に、その系のエンタルピーも増加します。
内部エネルギーとは
システムの内部エネルギーは、そのシステムの位置エネルギーと運動エネルギーの合計です。位置エネルギーは蓄えられたエネルギーであり、運動エネルギーは分子の運動によって生成されるエネルギーです。内部エネルギーは記号 U で与えられ、内部エネルギーの変化は ∆U として与えられます。
一定の圧力での内部エネルギーの変化は、その系のエンタルピーの変化に等しくなります。内部エネルギーの変化は、2 つの方法で発生する可能性があります。 1 つは熱伝達によるものです。システムは、外部から熱を吸収したり、周囲に熱を放出したりできます。どちらの方法でも、システムの内部エネルギーが変化する可能性があります。もう1つの方法は、仕事をすることです。したがって、内部エネルギーの変化は次のように与えられます。
ΔU =q + w
どこで、
ΔU 内部エネルギーの変化
q は熱伝達です
w システム上またはシステムによって行われる作業です
しかし、内部エネルギーが一定で、エネルギー移動がゼロで、仕事が行われないため、孤立したシステムは項 ∆U を持つことはできません。 ΔU の値が正の場合、システムが外部から熱を吸収し、システムで仕事が行われていることを示します。 ΔU が負の値の場合、システムは熱を放出し、システムによって仕事が行われます。
しかし、内部エネルギーは位置エネルギーまたは運動エネルギーとして存在できますが、熱や仕事としては存在できません。これは、システムが変化したときにのみ熱と仕事が存在するためです。
エンタルピーと内部エネルギーの違い
定義
エンタルピー: エンタルピーは、化学反応の進行中に吸収または発生する熱エネルギーです。
内部エネルギー: システムの内部エネルギーは、そのシステムの位置エネルギーと運動エネルギーの合計です。
方程式
エンタルピー: エンタルピーは H =U + PV として与えられます。
内部エネルギー: 内部エネルギーは ∆U =q + w として与えられます。
システム
エンタルピー: エンタルピーは、システムと周囲との関係として定義されます。
内部エネルギー: 内部エネルギーは、システム内の総エネルギーとして定義されます。
結論
エンタルピーは周囲と接触しているシステムに関連しており、内部エネルギーは特定のシステムを構成する総エネルギーです。ただし、エンタルピーの変化と内部エネルギーの変化は、システム内で進行している化学反応の種類と性質を決定する上で非常に重要です。したがって、エンタルピーと内部エネルギーの違いを明確に理解することが重要です。







