貴金属は、空気にさらされたときに酸化や腐食に強い金属のグループです。これらの金属が示す相対論的効果により、さまざまな条件で安定することができます。
ある時点で、誰かが「彼はとても高貴だ」または「この国の高貴な歴史について知っていましたか?」と言うのを聞いたことがあるかもしれません.しかし、「ほら、ここに貴金属が!」と言う人はめったにいません。ご存知のように、英語は非常に奇妙な言語であり、「高貴な」という言葉は、さまざまな分野や研究分野でさまざまな意味を持ちます。化学では、この用語は腐食や酸化に強い金属として定義されますが、原子物理学では、この定義は原子の電子配置 (原子のさまざまな殻における電子の分布) を扱います。
最も一般的な 8 つの貴金属には、金 (Ag)、銀 (Au)、プラチナ (Pt)、ロジウム (Rh)、イリジウム (Ir)、ルテニウム (Ru)、オスミウム (Os)、パラジウム (Pd) が含まれます。ご存じのとおり、最初の 3 つはジュエリーやその他の装飾品を作るのによく使用されます。これの唯一の理由は、空気にさらされたときの不活性と変化への抵抗です。これらの金属が「高貴」である理由を理解するために、化学の基礎から始めましょう!
貴金属は周期表のどこにありますか?
周期表は、1869 年にロシアの化学者ディミトリ メンデレーエフによって作成されました。これは、原子番号、電子配置、および化学的性質の類似性に従って並べられた化学元素の表示です。今日、周期表には 118 の既知の元素があります。要素は、化学的挙動に基づいてグループと期間に配置されます。貴金属は表の中央に位置し、遷移金属のグループに属します。すべての遷移金属は金属特性を持ち、電気の良導体です。
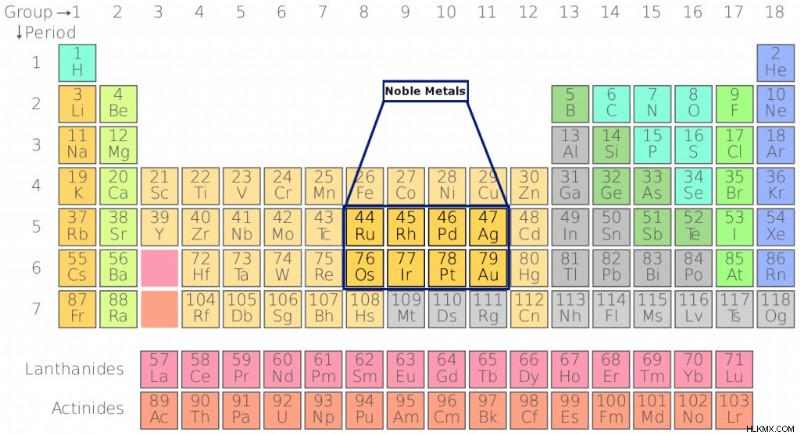
周期表における 8 つの一般的な貴金属の位置 (写真提供者 :Sandbh / Wikipedia Commons)
貴金属の背後にある化学は何ですか?
貴金属が最も反応性の低い金属の一部である理由を理解するには、それらの電子配置を知ることが重要です。元素の化学反応性は、原子が安定した状態を保つことを可能にする原子核の周りの電子の配置によって影響を受けます。要素が電子殻を完全に満たすと、安定性が得られます。
大学での退屈な化学の講義中のある時点で、ボーア モデルの背後にいる人物、ニールス ボーアの名前を目にしたことがあるかもしれません。彼は、原子には中性子と陽子を含む原子核があり、電子は特定の距離で電子殻内の原子核の周りを回転していると述べました.
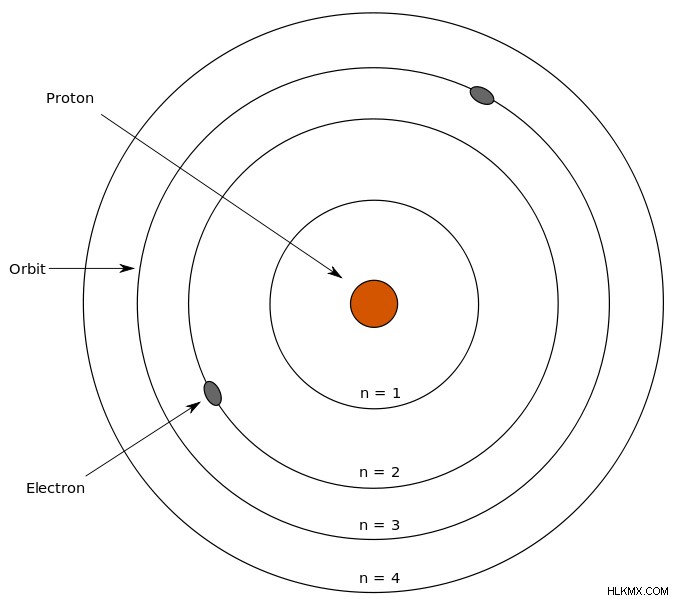
ボーア モデルの図。 (写真提供:Sharon Bewick/Wikimedia Commons)
電子はさまざまな殻で回転し、特定のエネルギーレベルを持っています。このエネルギーレベルは、原子核から遠ざかるにつれて増加します。これらのエネルギーレベルには、1、2、3、4 などの番号が付けられています。さらに、K、L、M、および N として指定された主なエネルギー準位または電子殻のそれぞれには、2n2 個の電子が含まれています。ここで、n は準位の数に対応します。
最初のレベルには 2(12) 個の電子 =2 個の電子があります
2 番目のレベルには 2(22) 個の電子 =8 個の電子があります
3 番目と 4 番目の準位には、同じ方法で計算された 18 個と 32 個の電子があります。電子は原子核から遠ざかるにつれてエネルギー準位が高くなります。したがって、第 6 エネルギー準位の電子は、第 1 準位の電子よりもエネルギーが高くなります。電子は最初に低いエネルギー準位を満たし、次に外側に移動します。時々、電子は完全できない y 殻を埋め、価電子を発生させます。これらの最も外側の電子は、原子の反応性に関与しています。これは、電子エネルギー準位について話すときに考慮すべき最も重要な側面の 1 つです。
それだけではありません。主な質問に答える前に、カバーする必要がある基本事項がいくつかあります。電子殻に関連する詳細をいくつか見ていきましょう。
サブシェルと軌道とは?
すべてのシェル (K、L、M、または N) には 1 つ以上のサブシェルが含まれ、すべてのサブシェルには原子軌道が含まれます。映画インセプションのワンシーンのように感じます。 貴金属の背後にある化学を最終的に理解するまで、あるシェルから別のシェルへと移動します。簡単にするために、綱引きのゲームのプレーヤーとして電子を想像してください。各電子は、自分自身の近くにある線 (原子核) の中心点を望んでいます。原子核から最も遠い電子は、原子核に近づくために大量のエネルギーを生成します。これは、ゲームで最強のプレーヤーをロープの端に置くのと同じです。ただし、綱引きのプレイヤーは、電子シェルの場合のようにロープの周りに群がるのではなく、一直線に配置されます。
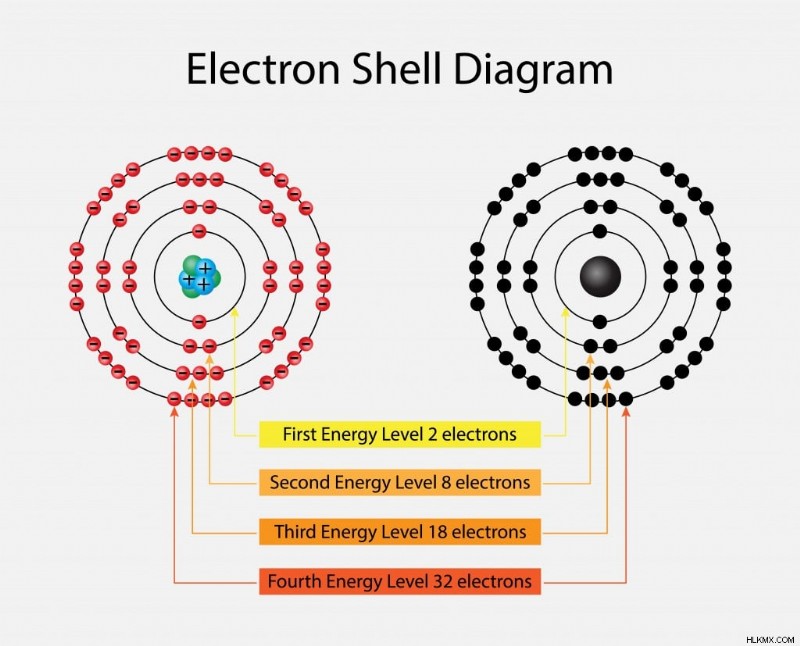
さまざまなエネルギー準位を示す電子殻。 (写真提供:Nasky/Shutterstock)
同様に、電子はシェルを過密状態にすることはなく、生きたまま放っておかなければなりません。これらは、s、p、d として指定されたサブシェルに適切に分散されています。 とf 2 つ以上の軌道を含むもの。すべての軌道には 2 つの電子しか含まれていないため、同じサブシェル内に多くの軌道が生じます。 2つの電子は同じ軌道で反対方向にスピンし、エネルギー差を生じます。 f の軌道の電子 サブシェルは s のものよりもエネルギッシュです サブシェル。
電子殻が完全に満たされた元素は、価電子がないため、他の元素よりも安定しています。
貴金属の反応性が最も低いのはなぜですか?
前述のように、価電子は、元素が他の元素と相互作用して化合物を形成する能力に関与しています。よりよく理解するために、金の化学を理解するために物事を絞り込みましょう.金 (79Au) の電子配置を詳しく観察すると、[Xe] 4f14 5d10 6s1 (Xe は最も近い希ガスであるキセノンを表し、4、5、6 はエネルギー準位を表し、上付き文字は中に存在する電子の数を表します)各サブシェル)、6 番目のシェルに 1 つの自由電子があることがわかります。したがって、金は最も外側の殻に 1 つの自由電子を持っているため、反応性があるべきではありませんか?
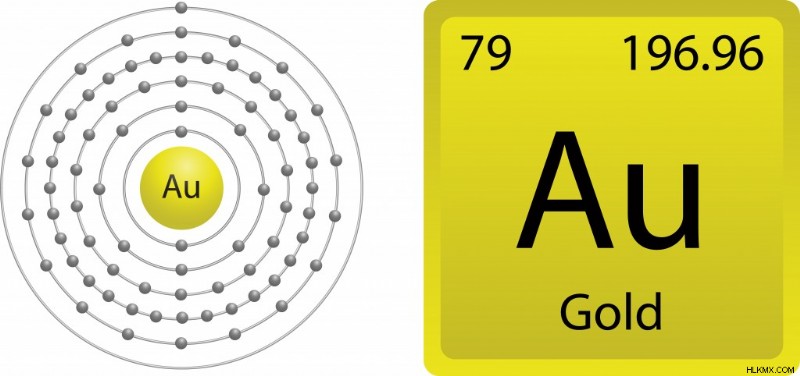
最外殻に単一電子を持つ金の電子配置。 (写真提供:gstraub/Shutterstock)
金の原子番号は 79 であるため、相対論的効果を示すことができます。金の原子核は重いため、電子は非常に速く移動するため、 電子は d よりも強く結合します。 と f 殻電子。これらの相対論的電子は質量を獲得し、6 収縮する軌道。この収縮により、電子が原子核により強く結合し、反応に利用できなくなります。したがって、最外殻に自由電子があるにもかかわらず、金は酸化に抵抗するという独特の特性を持っています。
結論として、貴金属は、化学的配置とそれぞれのシェル内の電子の位置により、酸化と腐食に対する反応性が低くなります。これにより、金属が鈍くなったり、腐食したり、望ましくない方法で反応したりする心配なく、特定の金属を歯科用鋳物として使用したり、さまざまな装飾品を作ることができます!