分解反応 化学反応の 4 つの主要なタイプの 1 つです。このタイプの反応は、分析反応または分解反応とも呼ばれます。ここでは、分解反応の定義、反応の例、および分解反応の認識方法について説明します。
分解反応の定義
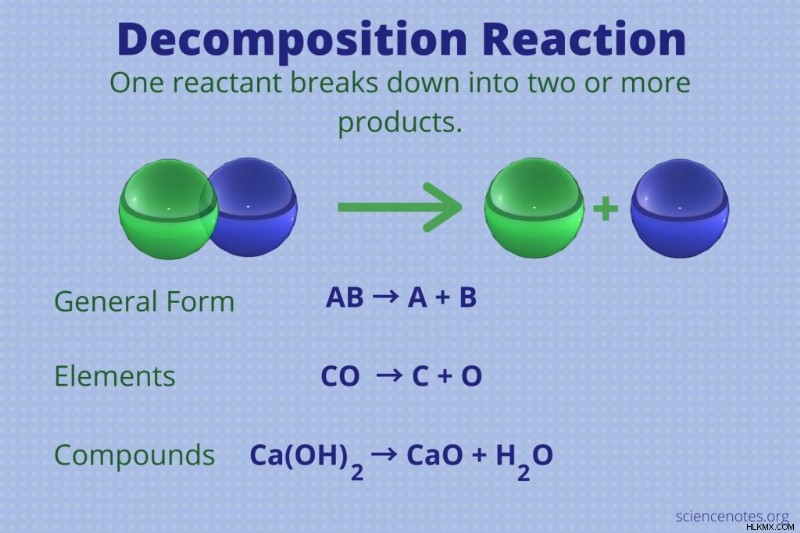
分解反応は、2 つ以上の生成物を形成する単一の反応物による化学反応です。
分解反応の一般的な形式は次のとおりです。
AB → A + B
分解反応により、より小さな分子が形成され、多くの場合純粋な元素が含まれます。
分解の反対
分解反応の反対は合成反応で、結合反応とも呼ばれます。合成反応では、2 つ以上の反応物が結合して、より複雑な生成物が形成されます。
分解反応の例
分解反応は、日常生活でよく見られます。一例として、酸素ガスと水素ガスを生成するための水の電気分解があります。
2 H2 O → 2H2 + O2
もう 1 つの例は、過酸化水素を分解して水と酸素を生成することです。
2 H2 O2 → 2 H2 O + O2
清涼飲料は、分解によって炭酸化されます。炭酸は水と二酸化炭素に分解されます。
H2 CO3 → H2 O + CO2
吸熱または発熱?
ほとんどの分解反応は吸熱です。言い換えれば、反応物中の化学結合を壊すには、生成物を作るために新しい化学結合が形成されるときに放出されるよりも多くのエネルギーが必要です.これらの反応は、進行するために環境からエネルギーを吸収します。たとえば、酸化水銀 (II) の水銀と酸素への分解 (ほとんどの金属酸化物の分解と同様) には、熱の入力が必要であり、吸熱的です:
2HgO → 2Hg + O2
ただし、いくつかの分解反応は発熱です。それらは吸収するよりも多くの熱を放出します。たとえば、亜酸化窒素の窒素と酸素への分解は発熱です:
2いいえ → N2 + O2
分解反応の見分け方
分解反応を特定する最も簡単な方法は、単一の反応物から始まり、複数の生成物を生成する反応を探すことです。また、身近な例を認識するのにも役立ちます。金属酸化物は金属と酸素を形成し、炭酸塩は通常、酸化物と二酸化炭素を生成します。
分解反応の種類
分解反応には、主に熱分解、電解分解、光分解の 3 種類があります。
- 熱分解 :熱により熱分解反応が活性化します。これらの反応は吸熱的である傾向があります。例としては、炭酸カルシウムの分解による酸化カルシウムと二酸化炭素の生成があります。
CaCO3 → CaO + CO2 - 電気分解 :電気エネルギーは、反応物が生成物に分解するための活性化エネルギーを供給します。例として、水素と酸素への水の電気分解があります。
2H2 O→ 2H2 + O2 - 光分解 :反応物は光 (フォトン) からエネルギーを吸収して化学結合を破壊し、生成物を形成します。例として、オゾンを分解して酸素を生成する場合があります。
O3 + hν → O2 + O
触媒は分解反応を助けることがあります。これらの反応は触媒分解と呼ばれます。
分解反応の用途
分解反応は望ましくない場合もありますが、いくつかの重要な用途があります。
- セメントやその他の用途に使用する生石灰 (CaO) を製造する
- テルミット反応で溶着すること
- 鉱石、酸化物、塩化物、硫化物から純粋な金属を抽出すること
- 胃酸過多の治療
- 通常、化合物に結合している水素を取得すること
- 分解生成物に基づいてサンプルの身元を特定すること
参考文献
- ブラウン、T.L.;ルメイ、H.E.; Burston, B.E. (2017)。 化学:中心科学 (第14版)。ピアソン。 ISBN 9780134414232.
- マクノート、A.;ウィルキンソン、A. (1997)。 「化学分解」。 化学用語集 (第2版)(「ゴールドブック」)」。ブラックウェル科学出版物。 doi:10.1351/goldbook.C01020