コア コンセプト
この有機化学チュートリアルでは、ウィリアムソン エーテル合成について、有機化学におけるその重要性、化学メカニズム、および最終的に注目すべき制限を含めて学習します。
Williamson Ether Synthesis とは?
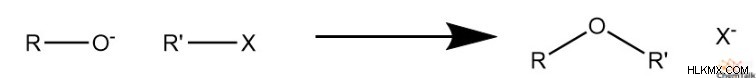
Williamson Ether Synthesis は、酸化物 (またはアルコール) とハロゲン化アルキルからエーテルを生成する一般的な有機化学反応です。英国の化学者アレクサンダー ウィリアムソンは、1850 年にクロロエタンをカリウム エトキシドと反応させてジエチル エーテルを生成する反応を最初に発見し、明確にしました。

この反応は、その使いやすさと多用途性から、研究と日常的な合成の両方において、有機化学実験室の定番となっています。極限でない条件下でいくつかの簡単な試薬を使用すると、多種多様なエーテル化合物を簡単に合成できます。
ウィリアムソンのエーテル合成メカニズム
前述のように、ウィリアムソン エーテルの合成には、ハロゲン化アルキルと反応するアルコールまたは酸化物が含まれます。これらの試薬は基本的に SN を実行します 2メカニズム。
アルコールを使用する場合、酸素を脱プロトン化するために塩基が必要です。通常、化学者は、水酸化ナトリウムや水酸化カリウムなどの不活性カチオンを含む一般的な強塩基を使用します。その結果、この塩基はアルコールを脱プロトン化し、電気陰性度の高い酸化物種を残します。多くの場合、静電引力により、塩基の陽イオンが酸化物と弱く結合します。
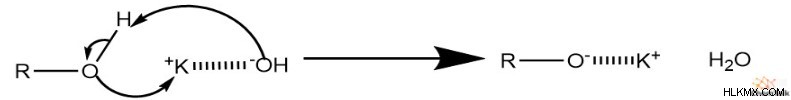
アルコキシド塩は、必要な酸化物種を生成するために即座に解離するアルコールの代替として機能します。
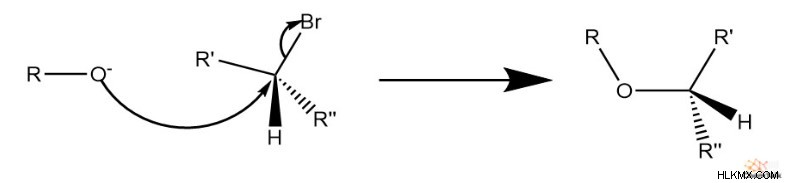
次に、SN 2 反応が始まる。酸化物はハロゲン化物に結合した炭素を攻撃し、ハロゲン化物を排出します。その結果、元のアルコールとハロゲン化アルキル種に対応するアルキル基を持つエーテルが生成されます。
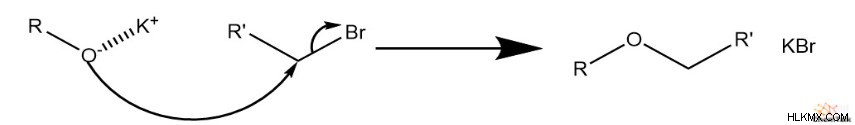
また、遊離ハロゲン化物が塩基カチオンと相互作用して塩を形成すると考えることもできます。ただし、溶液中では、両方のイオンがフリー スペクテーターとして留まる可能性があります。
有機化学実験室では、このメカニズムはアルコールとハロゲン化アルキルのほとんどの組み合わせに当てはまります。両方の基が同じ分子内に存在する場合、環状エーテルが自然に形成されることがよくあります。これは、グループが 1 つの炭素しか離れていない場合でも発生し、エポキシドを生成する信頼できる方法を提供します.
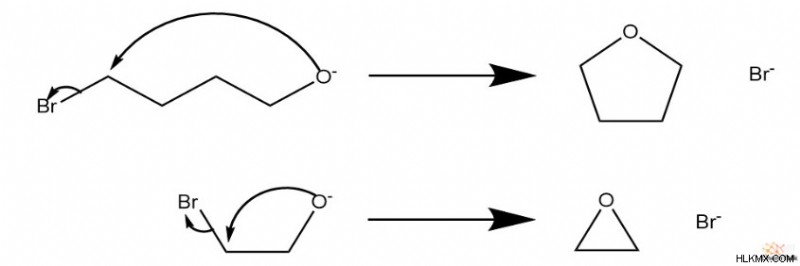
次のセクションで検討するように、立体的な制限を受けますが、非第一級ハロゲン化アルキルには特別な機構的考慮事項が含まれます。反応には SN が含まれるため 2 メカニズムでは、ハロゲン化物に結合した炭素のキラリティーが逆転します。これは、酸化物種の裏面攻撃によるものです
ウィリアムソン エーテル合成の制限
ウィリアムソン エーテル合成では、エーテル生成に影響を与える 3 つの重要な考慮事項があります。
- 溶剤
- 副産物の形成
- 触媒作用
溶媒の制限
反応物が意図したとおりに機能することを確認するには、非求核性溶媒を使用して反応を実行する必要があります。ウィリアムソン エーテル合成の一般的な溶媒には、トルエン、アセトニトリル、N,N-ジメチルホルムアミドなどがあります。
水やエタノールなどの求核溶媒は、SN 意図した酸化物種の代わりにハロゲン化アルキルに2。化学反応では溶媒が常に「過剰」に存在するため、ほぼすべてのハロゲン化アルキル分子が酸化物ではなく溶媒と反応します。

副産物の制限
ウィリアムソン エーテル合成条件の最も重要な考慮事項は、副生成物の形成を最小限に抑えることです。ほとんどの場合、SN の代わりに E2 反応を行う試薬により、アルケンとアルコールが最も一般的な副産物として機能します。 2.
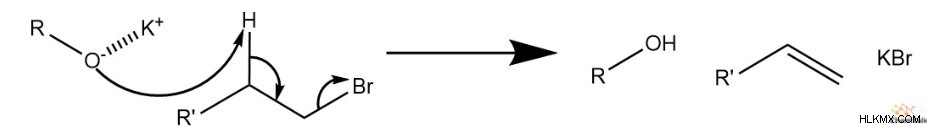
E2 機構は、酸化物とハロゲン化アルキルの両方またはいずれかがかさばる場合に有利になる傾向があります。分子量が多すぎると、試薬が互いに立体的に阻害します。このような場合、酸化物は、立体的に利用できないハロゲン化炭素ではなく、よりアクセスしやすい Ɑ-水素と反応する傾向があります。
その結果、一次酸化物と一次ハロゲン化物は、最高の収率で最も速く反応する傾向があります。二次酸化物も SN を確実に生成する傾向があります。 2 生成物ですが、二次ハロゲン化物は、多くの場合、収率の大幅な低下を伴います。三級酸化物とハロゲン化物はエーテルをほとんど生成しません。
触媒作用の制限
多くのウィリアムソン エーテル合成は触媒の助けを借りずに行うことができますが、あまり好まれていない反応物は少し速度論的な助けを必要とする場合があります。酸化銀は、そのような化学ヘルパーの 1 つとして機能し、ハロゲン化物を配位結合することによって反応を触媒します。これにより、炭素はより求電子的になり、SN をより助長します。 2 リアクション、
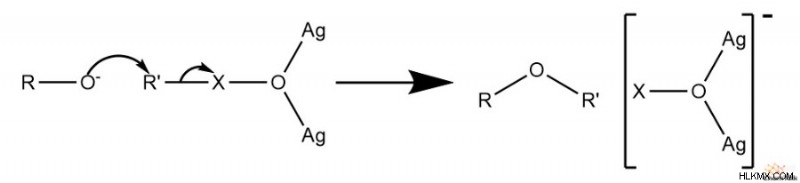
さらに、可溶性ヨウ素塩は、塩化物や臭化物などの反応性の低いハライド脱離基を置き換えることもできます。ただし、この追加は、重大な副産物形成の問題がない場合にのみ役立ちます.これは、ヨウ化物が両方の SN を作るためです。 2 と E2 の反応がより簡単になります。







