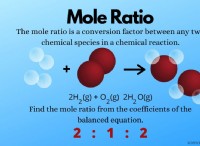
セシウム またはセシウム 元素記号 Cs、原子番号 55 の光沢のある淡い金色の金属です。セシウムは、室温で固体である最も柔らかい金属です。 28.5 °C または 83.3 °F で液体要素になります。ガリウムと同じように、手のひらの上で溶ける金属です (ただし、溶かさないでください)。ここには、要素の特性、用途、ソースなど、セシウムに関する興味深い事実がまとめられています。
セシウムの基本情報
名前 :セシウム (ASC、米国) またはセシウム (IUPAC、国際)
シンボル :Cs
原子番号 :55
原子量 :132.905451
グループ :グループ 1 (アルカリ金属)
期間 :期間 6
ブロック :sブロック
電子配置 :[Xe] 6秒
シェルあたりの電子数 :2, 8, 18, 18, 8, 1
発見 :Robert Bunsen と Gustav Kirchhoff は、1860 年にミネラルウォーターでセシウムを発見しました。彼らは分光器を使用して元素を発見し、スカイブルーの発光スペクトル線によって元素を特定しました。 Carl Setterberg は 1882 年に初めて純元素を分離しました。
名前 起源:セシウムは、ラテン語で「空色」を意味する caesius に由来します。これは、元素の空色のスペクトル線を指します。
同位体 :セシウムには 39 の同位体があり、質量数は 112 から 151 までの範囲です。唯一の安定同位体はセシウム 133 です。半減期が最も長い同位体はセシウム 135 で、半減期は 230 万年です。セシウム 137 は、核兵器の実験によって生成された注目すべき同位体です。
生物学的役割と毒性 :セシウムは、どの生物においても既知の生物学的機能を果たしません。セシウムの非放射性同位体は軽度の毒性があります。たとえば、塩化セシウムは、塩化ナトリウム (食卓塩) または塩化カリウムとほぼ同じくらい毒性があります。毒性の症状には、低血圧、胃のむかつき、唇のチクチク感などがあります。セシウムの過剰摂取は、低カリウム血症 (低カリウム)、低マグネシウム症 (低マグネシウム)、頻脈 (速い心拍数)、そして時には心臓発作につながります。純粋なセシウムに触れることは、発火または水と爆発的に反応するため、賢明ではありません。放射性同位元素は体内に蓄積しにくい物質ですが、非常に危険です。犬を使った実験では、体重 1 キログラムあたり 4.1 μg のセシウム 137 が致死量であることが示されています。低用量は不妊症や癌を引き起こす可能性があります.
用途 :セシウム 137 の主な用途は、掘削流体のトレーサーとしての石油産業です。セシウム 137 は、食品照射、がん治療、原子時計、触媒、光電セル、真空管のゲッターとしても使用されています。非放射性同位元素とその化合物は、特殊ガラス、赤外線フレア、ビール醸造に使用されています。
ソース :セシウムは、地球の地殻に約 3 ppm の量で存在する比較的まれな元素です。これにより、地殻で 45 番目に豊富な元素になります。原子はサイズが大きいため、多くの鉱物結晶から除外されます。セシウムを含む数少ない鉱物には、ポルサイト、シルバイト、カーナライト、ベリル、アボガドライト、ペッツォタイト、ロジザイト、ロンドナイトなどがあります。セシウム含有鉱石の最も豊富な供給源は、カナダのマニトバ州にあるタンコ鉱山です。他の供給源は、ジンバブエのビキタ鉱床とナミビアのカリビブ砂漠です。ポルサイトからの抽出手順は、酸消化、アルカリ分解、または直接還元です。
物理データ
要素の分類 :アルカリ金属
密度 :1.93g/cm
融点 :301.7 K (28.5 °C, 83.3 °F)
沸点 :944 K (671 °C, 1240 °F)
STP でのフェーズ :固体
外観 :ペールゴールドメタル
フュージョン ヒート :2.09 kJ/mol
モル熱容量 :32.210 J/(mol・K)
結晶構造 :体心立方 (bcc)
熱膨張 :97 µm/(m·K) (at 25 °C)
熱伝導率 :35.9 W/(m・K)
電気抵抗率 :205 nΩ·m (20 °C)
磁気注文 :常磁性
ヤング率 :1.7GPa
体積弾性率 :1.6GPa
モース硬度 :0.2
ブリネル ハ rdness :0.14MPa
原子データ
原子半径 :午後265時
原子量 :70.0 cc/mol
共有半径 :244±午後11時
ファン デル ワールス半径 :午後343時
イオン半径 :167 (+1e)
ポーリングの電気陰性度 :0.79
第一イオン化エネルギー :375.7 kJ/mol
酸化状態 :-1、+1
興味深いセシウムの事実
- ほとんどの人は、金色の要素は金だけだと思っています。ただし、セシウムには明確な金色のキャストがあります。
- セシウムは反応性が高い。空気中で自然発火し、水に触れると爆発する。このため、人々はセシウムを密閉容器、不活性ガスまたは液体、または真空内に保管しています。
- セシウムは非常に柔らかく延性があるため、非常に細いワイヤーに簡単に引き込むことができます。
- セシウムを手で溶かすのは非常に危険ですが、固体のセシウムの入った容器を手に持つことはできます。また、金属が冷えると美しい結晶が形成されます。
- セシウムは、アレン電気陰性度スケールを使用して、周期表で最も電気陰性度の高い元素です。条件によっては、共有結合半径も最大になります。
- 水酸化セシウム (CsOH) は非常に強い塩基であるため、ガラスを通り抜けます。
- 2009 年、純度 99.8% のセシウムの価格は 1 グラムあたり約 10 ドル、または 1 オンスあたり 280 ドルでした。
- 核兵器の実験中に放出されたセシウム 137 は土壌に沈降し、「現代の」堆積物の信頼できるマーカーです。
参考文献
- ビック、マンフレッド。プリンツ、ホルスト (2005)。 「セシウムおよびセシウム化合物」 Ullmann's Encyclopedia of Industrial Chemistry 2005 .ワインハイム:Wiley-VCH. doi:10.1002/14356007.a06_153
- Greenwood, N.N.; Earnshaw, A. (1984).元素の化学 .オックスフォード、イギリス:ペルガモン プレス。 ISBN 978-0-08-022057-4.
- Lide, David R., ed. (2006)。 化学および物理学の CRC ハンドブック (第87版)。フロリダ州ボカラトン:CRC Press. ISBN 0-8493-0487-3.
- Melnikov, P.;ザノニ、L. Z. (2010 年 6 月)。 「セシウム摂取の臨床効果」。 生物学的微量元素研究 . 135 (1–3):1–9. doi:10.1007/s12011-009-8486-7
- 数週間、メアリー・エルビラ (1932)。 「元素の発見。 XIII。いくつかの分光学的発見」. Journal of Chemical Education . 9 (8):1413–1434。 doi:10.1021/ed009p1413