コア コンセプト
このチュートリアルでは、命名法とイオン化合物の命名について学びます。 .二元および多原子イオン化合物の化学式から名前を導き出します。
他の記事で取り上げるトピック
- 有機化合物の IUPAC 命名法
- 共有結合化合物の命名
- 分子と化合物
- アルカンの命名
- 一般的な多原子イオン
語彙
- 複合: 2 つ以上の化学元素の原子で構成される分子を含む物質 (イオン性または共有結合性)
- イオン: 電荷を持つ原子または原子団
- 料金: (陽子-電子) を減算することによって見つかります。電子移動によるイオン結合時の変化
- 陽イオン:正に帯電したイオン。中性原子が電子を失うときに形成される
- 陰イオン:正電荷を帯びたイオン。中性原子が電子を失うときに形成される
- イオン結合: 陽イオンと陰イオンの間の電子の移動によって形成される化合物
- 陽イオン参加者はほとんど常に金属です
- 陰イオン参加者はほとんどの場合、非金属です
- 二元イオン化合物: 2 つの構成要素があり、それぞれが 1 つの要素
- の原子で構成されています。
- 単原子:1 つの要素のみの原子
- 多原子イオン化合物: 各構成要素には複数の元素の原子が含まれています
- 多原子陽イオンおよび陰イオンとして単独で使用可能
- 単一の充電ユニットとして機能
- 結合して化合物を形成できます
- 多原子陽イオンおよび陰イオンとして単独で使用可能
はじめに
イオン性化合物とはイオン化合物は、原子または分子が反対の電荷を持つ他の分子を引き付けるときに形成されます。この相互作用は通常、正電荷を持つ金属と負電荷を持つ非金属の間で発生します。参加者間の静電引力は、参加者間の電子移動を促進します。
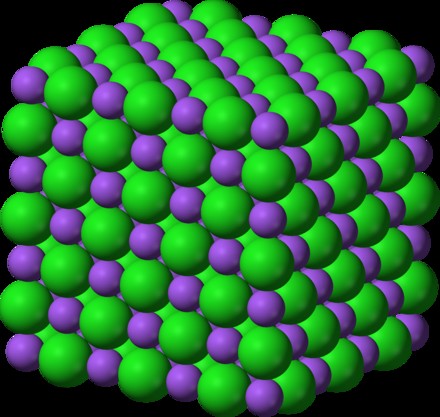
これらの化合物は、「格子」構造に配置されます。イオン格子は、各イオンがそれを取り囲む反対に帯電したイオンと規則的なパターンを形成することを保証します。これらの化合物に名前を付けるには、それらのイオン成分を考慮する必要があります.
二元イオン化合物
まず、二元イオン化合物の名前の付け方を学びます。 2人の参加者は単原子である可能性があります。あるいは、それぞれが複数の原子で構成されている場合もあります。いずれにせよ、バイナリイオン命名プロセスが適用されます。
金属とハロゲン化物または酸素との化合物は通常、イオン性固体です。 、陽イオンと陰イオンをつなぐ格子があり、静電気力で一緒に保持されています.
最初に陽イオンに名前を付けてください
陽イオン、または正に帯電した粒子は、常に化合物の名前で始まります。ただし、特定の命名規則は元素グループによって異なります。
グループ 1 と 2
周期表の第 1 族と第 2 族に含まれる元素は、常にそれらの族番号に等しい電荷を持つイオンを形成します。この着実な傾向は、これらの元素の 1 つを含む化合物が単にその名前で始まることを意味します。
たとえば、グループ 1 のカリウム イオンは常に 1+ の電荷を持っています。したがって、その化合物の名前は「カリウム」で始まります。 2組目も同様です。 2+ 電荷を持つマグネシウム カチオンを含む化合物に名前を付けるには、「マグネシウム」と書き始めます。
これら 2 つのグループ以外のいくつかの金属も、ほぼ常に同じ電荷を持っています。アルミニウム、亜鉛、スカンジウム、および銀は通常、それぞれ +3、+2、+3、および +1 の電荷を持っているため、他の金属のようにローマ数字を使用しない.
アニオンの命名
陽イオンの名前を書いた後、単原子陰イオンの名前の後に接尾辞「ide」を付けることができます。たとえば、化学式 KCl は「塩化カルシウム」という名前を生成します。
遷移金属カチオンの命名
しかし、グループ 1 と 2 を超えると、状況は少し難しくなります。化合物は中性またはゼロの正味電荷を必要とすることを思い出してください。陽イオンの正電荷は、陰イオンの負電荷と釣り合う必要があります。
遷移金属と呼ばれる 3 ~ 12 族の元素は、状況に応じてさまざまな数の電子を失います。それらは異なる電荷を持つ陽イオンを形成し、異なる特性を持つユニークな化合物を生成します。遷移金属陽イオンの電荷は、すべての原子を考慮して、指定された陰イオン構成要素の逆の値と等しくすることで決定します。
在庫システム
これらの変動に対処するには、ストック システムを使用します。この方法では、ローマ数字を使用して化合物中の陽イオンの電荷を示します。数字を括弧で囲み、その後に「ion」という単語を続ける必要があります。
Fe と Fe は重要な例です。鉄は 2+ チャージまたは 3+ チャージのいずれかを運ぶことができます。陰イオンが 3- 電荷を持つ場合、陽イオンには 3+ 電荷を選択します。陰イオンが 2- 電荷を持つ場合、陽イオンには 2+ 電荷を選択します。陽イオンを「鉄(II)」または「鉄(III)」と呼ぶことで、どちらが該当するかを明確にすることができます。
繰り返しますが、1 つの電荷だけでイオンを形成する元素は、このように記述する必要はありません。この方法により、特に遷移金属電荷に関するあいまいさが解消されます。
この場合、陰イオンを書き込むプロセスは変わりません。遷移元素の陽イオンとその電荷の後に陰イオン元素の名前を付けます。たとえば、化合物 Co2 Cl は「塩化コバルト(II)」という名前に変換されます。
二元イオン化合物の例:
- NaCl:塩化ナトリウム
- ZnI2 :ヨウ化亜鉛
- アル2 O3 :酸化アルミニウム
- FeCl3 :塩化鉄(III)
- PbO:酸化鉛 (II)
多原子イオン化合物
多原子化合物には、複数の種類の原子が含まれています。
NaNO3 に例示されるように、1 つの単原子成分と 1 つの多原子成分を持っている可能性があります。 、硝酸ナトリウム。または、(NH4)2SO4、硫酸アンモニウムに見られるように、2 つの多原子成分を持つこともできます。
多原子イオン化合物は、最初は複雑に見えるかもしれません。それら自体が化合物であるため、それらのタイトルには慣習化された名前が含まれています。しかし、それらの命名プロセスには、最初に陽イオンを書き、その後に陰イオンを書くことも含まれます.
たとえば、NaNO3 「硝酸ナトリウム」といいます。ナトリウムは、上記と同じ規則に従って命名されています。でもNO3 、それ自体の化合物であるため、「硝酸塩」と呼ぶ必要があります。 (NH4)2SO4 には、アンモニウムと硫酸塩という 2 つの多原子イオンが含まれています。陽イオン成分と陰イオン成分が結合すると「硫酸アンモニウム」になります。
多原子イオン化合物の例:
- CaCO3 :炭酸カルシウム
- NH4NO3 :硝酸アンモニウム
- KNO3 :硝酸カリウム
- Fe(OH)2 :水酸化鉄 (II)
- ナ3 PO4 :リン酸ナトリウム
- Sn3 (PO4 )4 :リン酸スズ (IV)
イオン化合物に名前を付ける際にそれらを使用できるように、一般的な多原子陽イオンと陰イオンに精通している必要があります。以下の表は、注意すべき陽イオンと陰イオンの概要を示しています。
一般的な多原子イオン:
| 多原子カチオン | 多原子陰イオン |
| NH4 :アンモニウム | NO3 :硝酸塩 |
| H3 O:ヒドロニウム | NO2 :亜硝酸塩 |
| OH:水酸化物 | |
| ClO3 :塩素酸塩 | |
| ClO2 :クロライト | |
| CrO4 :クロメート | |
| CO3 :炭酸塩 | |
| HCO3 :炭酸水素塩 | |
| CH3 COO:アセテート | |
| SO4 :硫酸塩 | |
| SO3 :亜硫酸塩 | |
| PO4 :リン酸塩 | |
| PO3 :ホスファイト | |
| CN:シアン化物 | |
| C2 O4 :シュウ酸 |
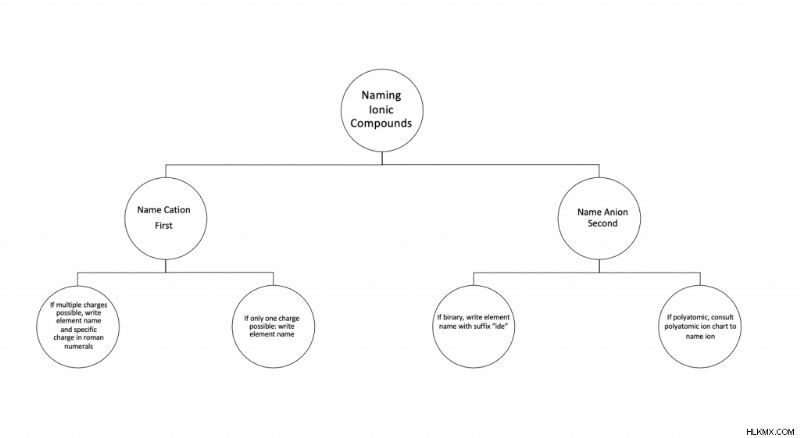
イオン性化合物を命名するための簡略化された手順
イオン化合物の命名に関するこの情報を確認するには、次のフローチャートを参照してください。さまざまなシナリオでの命名プロセスの手順が含まれています。また、イオン化合物ワークシートを試すこともできます。
イオン化合物の性質
イオン性化合物は、多くの類似した特性を共有しています。それらが何であるかを見てみましょう:
- 結晶性固体です
- 硬くてもろく、粉々になると滑らかな面に沿って折れることがよくあります
- 結晶格子が強いため、融点と沸点が高い
- 水に溶ける場合、非極性溶媒にはしばしば不溶です
- 気化と核融合のエンタルピーが高い
- 固体としては絶縁性があり、電気を通しませんが、溶けたり、水に溶けたりすると電気を通します