コア コンセプト
共鳴構造に関するこのチュートリアルでは では、共鳴構造とは何か、分子が持つ可能性のある共鳴構造をすべて見つける方法を学びます。また、これらの構造間の安定性を特定して比較する方法も学びます。
他の記事で取り上げるトピック
- 電気陰性
- ルイス ドット構造
- 正式な料金
共鳴構造とは?
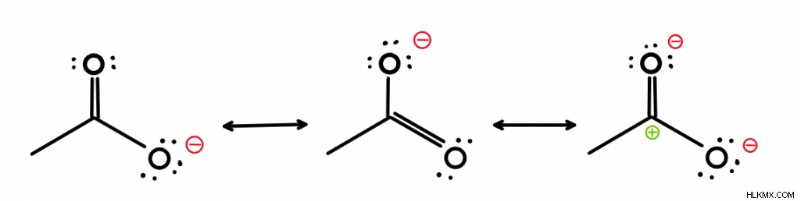
共鳴構造は、同じ分子のさまざまな形態であり、電子 ある地域から別の地域に移転しました。
なぜ共鳴構造が重要なのですか?
共鳴構造は、分子の形状をより現実的に捉えるために重要です。個々の共鳴構造が平均化されて共鳴ハイブリッドになることに注意してください。 これは分子の真の形状であり、最も安定した共鳴形態でもあります。
分子の共鳴構造はどのように見つけますか?
共鳴構造を描くときは、次の点に注意してください:
<オール>- これには、孤立電子対とパイ結合が含まれます (覚えておいてください:二重結合には 1 つのパイ結合があり、三重結合には 2 つのパイ結合があります)。
- しない 単結合 (シグマ結合とも呼ばれます) を切断します。
- これは、最も近くにある 3 つの原子に注目し、分子を下っていくということです。
- これは、電子を負電荷から正電荷に押し出すことを意味します。
例:オゾン (O3) の共鳴構造をどのように描きますか? )?
オゾンとは?
まず、オゾンについて見てみましょう。地球の成層圏にあるオゾン層について聞いたことがあるでしょう。それが「オゾン層」と名付けられた理由は、太陽の紫外線の大部分を吸収するオゾンの濃度が高いためです。化学では、標準還元電位が大きいため、最も強力な酸化剤の 1 つです。
オゾンのルイス構造を描く
オゾンの共鳴構造を求めるために、オゾンのルイス構造を描きます。分子式はO3なので 、18個の価電子があることがわかっています(酸素には6 x 3 =18として6個の価電子があります)。すべての電子を配置すると、二重結合と単結合ができます。
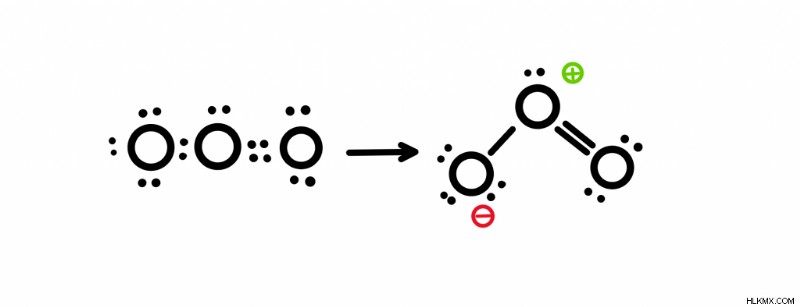
共鳴構造の描画
上部の酸素には正の形式電荷があり、左側の酸素には負の形式電荷があることに注意してください。形式電荷を見つけるには、原子が所有する電子の数を数えます それをその価電子と比較します。たとえば、一番上の酸素は 5 個の電子を持っています。電子のうちの 2 つは孤立電子対で、残りの 3 つは結合から来ます。結合に含まれる電子は 1 つだけであることを忘れないでください。したがって、6 – 5 =+1 です。下部の酸素についても同じことが続きます。左下には 7 個の電子があり、6 – 7=-1 です。価電子の数を見つけるには、周期表の上部にあるグループ番号を参照してください。
ステップ 1:負電荷を持つ酸素上で電子を移動させ、二重結合に変えます。
ステップ 2:正の酸素と中性の酸素の間の二重結合を切断します。かつて単結合にあった 2 つの電子を右の酸素に配置します。
ステップ 3:右下の酸素にマイナスの電荷を追加します。形式的な電荷が -1 になったからです。
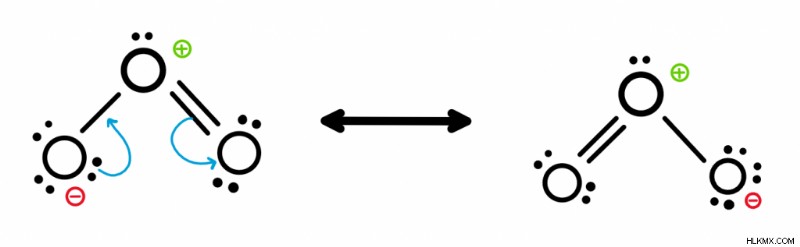
構造を区切る矢印の頭が 2 つあることに注目してください。共鳴構造は、これを使用して、前後に移動する電子の流れを示します。新しい独自の共鳴構造を作成できなくなったら、停止できます。
最も安定した共鳴構造をどのように決定しますか?
エネルギー量が最小の共鳴構造は、最も安定していることが知られています。特異構造の安定性が高いほど、共鳴ハイブリッドに寄与するため、これは重要です。最も安定した構造は、主な貢献者として知られています .一方、最も不安定な構造はマイナー コントリビューターとして知られています。 .どの共鳴構造が最も安定しているかを調べるには、従うべき 5 つの主なルールがあります。 (注:2 つの構造が等しい場合、それらは等しく寄与します。)
共鳴安定性ルール:
<オール>例:最も安定している構造は?
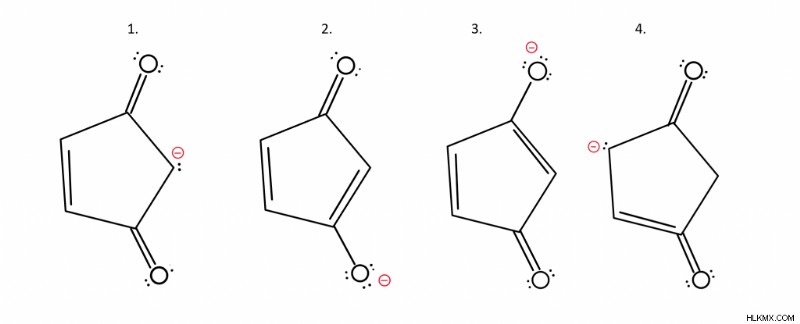
最初に気付くべきことは、負電荷が構造ごとに異なる領域にあるということです。私たちが知っていることに戻ると、最も安定した構造は、最も電気陰性度の原子に負電荷を持っています.この場合、酸素と炭素の 2 つの異なる原子があります。電気陰性度が高いのはどれ?あなたが酸素と言ったなら、あなたは正しいです。したがって、構造 2 と 3 は 1 と 4 よりも安定しています。
構造 2 と構造 3 では、どちらがより安定していますか?
答えは、それらは同等であり、したがって主要な貢献者として同等に貢献するということです.
参考資料:
結合順序 vs 結合長
分子式 vs 経験式