イオン化エネルギーとは?
イオン化エネルギー 、イオン化ポテンシャルとも呼ばれます 、周期表のすべての要素が持っているプロパティです。では、イオン化エネルギーの定義は何ですか?これは、イオンを形成する中性原子から電子を取り除くのに必要なエネルギー量です。通常、kJ/mol で測定され、気相中の孤立した原子に基づいて測定されます。計算方法、第 1 イオン化エネルギーと第 2 イオン化エネルギーの意味、周期表での傾向を学びましょう。
イオン化エネルギーは次の式で表すことができます:
X + 最初のイオン化エネルギー → X + e
どこ
- X は中性原子です
- X は、単一の正電荷を持つ原子 X のイオンです
- e は単一の負電荷を持つ電子です
「最初の」イオン化エネルギーとは何を意味しますか?
この式で、「最初のイオン化エネルギー」とは、中性原子の最初の電子を取り除き、単一の正電荷を持つイオンを与えるのに必要なイオン化エネルギーを指します。二次イオン化エネルギーは、1+ イオン (単一の正電荷を持つイオンを意味する) から 2 番目の電子を除去して、2+ 電荷を持つイオンを生成するのに必要なエネルギー量です。
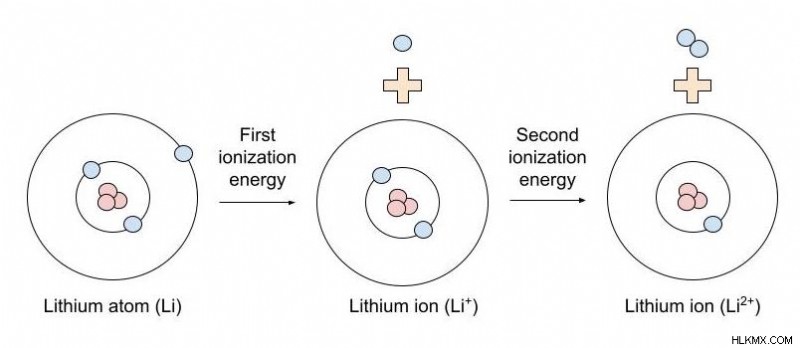
イオンとは?
イオンは、正または負に帯電した原子です。イオンは、その陽子の数と等しくない数の電子を持つことによって電荷を取得します。たとえば、Na とも表記されるナトリウム イオンには、11 個の陽子と 10 個の電子があります。電子よりも陽子が 1 つ多いため、イオンは正に帯電します。原子またはイオンの陽子の数は常に一定です (陽子の数によって原子番号が決まります)。
イオン化エネルギーの計算方法
水素のイオン化ポテンシャル 次の式を使用して計算できます:
E =hcR H (1/n)、ここで
- E は電子のエネルギー (または電子を除去するのに必要なエネルギー量、イオン化エネルギー)
- h プランク定数 =6.626 * 10 Js (ジュール*秒)
- c は光速 =3.00 * 10 m/s (メートル/秒)
- R H リュードベリ定数 =1.097 * 10 m (1/メートル)
- n は電子の主量子数 (またはエネルギー レベル) です
定数の値を代入すると、式は次のようになります:
E =(2.18 * 10 J)(1/n)
ここから、電子のエネルギー準位の値を差し込んで、電子を除去するのに必要なエネルギー量を見つけることができます。
周期表におけるイオン化エネルギーの傾向

周期表のイオン化エネルギーの傾向については、常に元素の最初のイオン化エネルギーを参照していると仮定します。一般に、(最初の) イオン化エネルギーは周期表の右上隅に向かって増加し、ヘリウムのイオン化エネルギーが最も高くなります。トレンドを期間とグループのトレンドに分類する前に、このトレンドの主な要因であるオクテット ルールについて説明しましょう。
オクテット ルール
オクテット規則によれば、原子は 8 個の価電子の完全なセットを持とうとします。これは、この構成がアトムに最も安定性を提供するためです。グループ 18 の希ガスは電子のオクテットを持っているため、化学的に不活性で非反応性になります。希ガス原子は他の元素と反応しません。これは、それらが持つ電子のオクテットにより、すでに非常に安定しているためです。
オクテット規則は、周期表のイオン化エネルギーの傾向とどのように関係していますか?原子はオクテットを持つように努力するため、各原子のイオン化エネルギーは、それらが持つ電子の数によって異なります。この関係をイオン化エネルギー期間の傾向と直接見てみましょう.
期間の傾向
一定期間にわたって、イオン化エネルギーは増加します。前述のように、要素は価電子の完全なオクテットを持つように努めます。元素が一定期間にわたって連続してより多くの電子を持つようになると、原子は目標にどんどん近づいていきます。そのため、原子がオクテットに近づくにつれて、電子を除去することがますます難しくなり、イオン化エネルギーが増加します。オクテットから非常に離れた原子から電子を取り除くのは非常に簡単です.
1 つの価電子を持つグループ 1 の要素は、電子のオクテットを持つために、容易にその電子を失います。したがって、グループ 1 の元素は非常に低いイオン化エネルギーを持っています。電子がなくても原子はより安定するため、電子を取り除くのに必要なエネルギーはごくわずかです。
スペクトルの反対側では、17 族元素は非常に高いイオン化エネルギーを持っています。これは、7 つの価電子で、ハロゲンが獲得したいためです。 オクテットを形成するためのもう1つの電子。電子を失うと、目標から遠ざかります。したがって、電子を取り除くには、より多くのエネルギーが必要になります。
グループ トレンド
グループを下ると、イオン化エネルギーが減少します。これは、グループを下るにつれて、電子が原子核の引力から離れて、連続的に高いエネルギー準位に位置するためです。さらに、グループを下ると、外側の価電子と原子核の間にさらに多くの電子があります。これらの中間電子は、核の引力から外側の電子を「保護」するのに役立ちます。したがって、グループの下から電子を取り除く方が簡単です.
グラフ上の周期表の傾向

グラフからわかるように、希ガスのイオン化エネルギーが最も高く、アルカリ金属のイオン化エネルギーが最も低くなります。グループ 1 と 18 の間では、イオン化ポテンシャルは通常、一定期間にわたって増加します。
さらに読む
- 原子半径の傾向
- 原子とは
- 電気陰性度の傾向
- 定期的なトレンドを簡単に
- 周期表の読み方