コア コンセプト
このチュートリアルでは、価電子について学びます 、それらが何であるか、なぜそれらが重要なのか。また、元素が持つ価電子の数を知る方法も学びます.
他の記事で取り上げるトピック
- 周期表の読み方
- 定期的なトレンドを簡単に
- イオン結合と共有結合
- 電子殻構成
- 電子軌道と軌道形状
価電子とは?なぜ重要なのですか?
価電子は、原子の最も外側の電子殻にある電子です。これらの電子は、原子核から最も離れているため、原子に最も強く保持されていないため、結合と反応に関与する電子です。これはまた、元素が持つ価電子の数が、その反応性、電気陰性度、および形成できる結合の数を決定することを意味します.
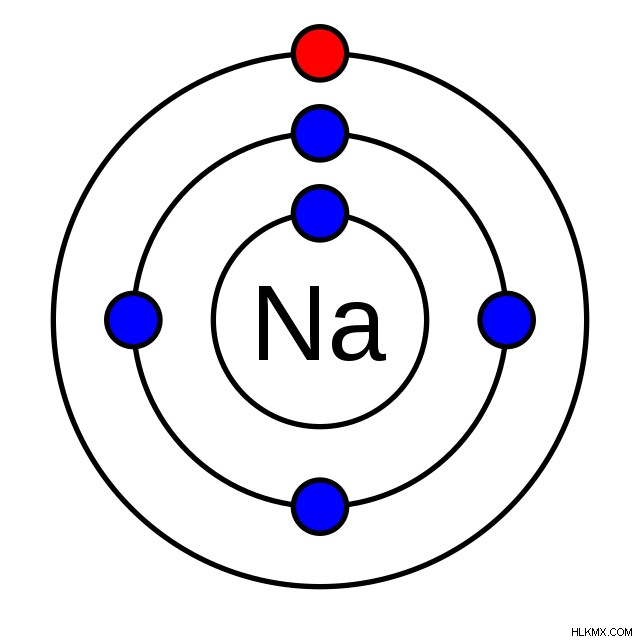
たとえば、ナトリウムの電子配置の簡略図を示す下の図では、価電子は赤で示されています。最も外側のシェルにあります (この場合、シェルはリングに似ています)。
原子価という用語 元素が他の原子と結合を形成する能力を指します。元素の原子価は歴史的に、結合できる水素原子の数によって決定されていました (結合に利用できる価電子の数によって決定されます)。たとえば、炭素は CH4 を形成できます。 したがって、価数は 4 で、価電子は 4 です。一方、窒素はNH3を形成することができます したがって、3 価の価電子と 3 価電子があります。
元素にはいくつの価電子がありますか?
周期表を使用して、元素 (具体的には、元素の中性原子) が持つ価電子の数を決定できます。 グループを見てください グループ番号は要素が持つ価電子の数を示すため、要素が含まれていること。
ただし、この規則は遷移金属以外の元素にのみ適用されることに注意してください。遷移金属は、より複雑な電子配置を持っています。したがって、元素の特定の電子殻構成を調べて、それを把握する必要があります。
これは、グループ番号を見るときに、遷移金属を除外することも意味します。それらは周期表の真ん中のブロックにあります。この意味で、下の図のグループ 1 と 2 は同じままですが、グループ 13 は新しい「グループ 3」、グループ 14 は新しい「グループ 4」などです。
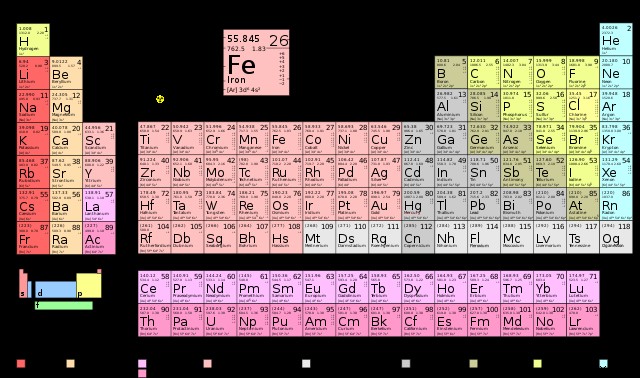
例
たとえば、ナトリウムはグループ 1 にあり、1 つの価電子を持っていることを示します。これを確認するために、その電子殻構成をチェックできます:1s2s2p3s.ご覧のとおり、3s 軌道には 1 つの電子があり、これが最も外側の電子です。
別の例は、塩素の例です。塩素は 7 族に属し、7 つの価電子を持つことを示します。これを確認するために、その電子殻構成を見てみましょう:1s2s2p3s3p.ご覧のとおり、3s 軌道と 3p 軌道を合わせた 7 個の電子があり、これらが合わさって最も外側の 3 番目の軌道を構成しています。
最後に、グループ 4 にある炭素を見ることができます。これから、原子価殻に 4 つの電子があると推測されます。確認するために、その電子殻構成で確認します:1s2s2p。ご覧のとおり、2s 軌道と 2p 軌道を合わせた 4 つの電子があり、これらが合わさって最も外側の 2 番目の軌道を構成しています。
注目に値するケースはグループ 8 のケースです。このグループの元素は 8 個の電子を持ち、完全なオクテットを構成します。そのため、希ガスとして知られるこれらの元素は特別なものになります .電子殻の完全なオクテットが非常に安定しているため、結合や反応に利用できる価電子は事実上ありません。
さらに読む
- 電気陰性
- 求核剤
- 求電子剤
- カルボカチオン安定性
- ルイス酸と塩基