コア コンセプト
水素結合 特に生物系における多くの分子作用に関与する重要な分子間力です。このチュートリアルでは、水素結合の定義、例、および化学と生物学において水素結合が非常に重要である理由を学びます.
他の記事で取り上げるトピック
- 分子間力
- イオン双極子力
- イオン結合と共有結合
- 水素
語彙
- 分子間力: 同じ物質内の相互作用する分子間の力。これらは、分子内の原子間に存在する力である分子内力とは異なります。
- イオン結合: 反対に帯電した 2 つのイオン間の静電引力によって形成される結合。例:Na と Cl がイオン結合を形成して NaCl を生成
- 共有結合: 電子を共有する 2 つの原子によって形成される結合。例:CO
- ダイポール: 電子の自然な動きによる原子の部分的な電荷で、それ以外の場合は中性の分子に部分的な正と負の電荷が生じます。
水素結合とは?
水素結合は、ある分子内の水素と別の分子の電気陰性原子との間で発生する分子間力の一種です。具体的には、水素と、酸素、フッ素、または窒素の 1 つ以上の原子を含む化合物の間でのみ発生します。水素結合はこれらの分子にしか起こらないことを覚えておく賢い方法は、「化学はFON(楽しい)」です。水素結合は、3 種類の分子間力の中で最も強力です。
水素結合は共有結合と同じですか?
いいえ .水素結合はインターです 分子力、共有結合はイントラ 分子力。これらの結合は、多くの共有結合化合物に存在することがよくありますが、共有結合とは大きく異なります。これらの結合は強力ですが、共有結合ほど強くはなく、頻繁に壊れたり、絶えず再形成されたりします.
水素結合はどのように発生しますか?
これらの結合は、水素が 1 つの分子で正の双極子を形成し、フッ素、酸素、または窒素が別の分子で負の双極子を形成するときに発生します。水素の正双極子は、電気陰性原子の負双極子に引き付けられ、2 つの分子間に引力が生じます。
水素結合の例
水素結合の一般的な例を見ると、水素結合の理解がより簡単になります。
水中の水素結合
水中の水素結合は、水の多くの特性において重要であるため、これらの結合の最も一般的な例です。水中では、ある分子の酸素と別の分子の水素の間で水素結合が発生します。

これらの結合は、凝集力 (水がそれ自体に付着する能力)、接着力 (水が他の分子に付着する能力)、表面張力、高い比熱、およびその溶媒特性など、水の重要な特性をもたらします。
DNA の水素結合
水素結合は、DNA の構造とその特性の理由であるため、生物学において非常に重要です。これらの結合は、ヌクレオチド塩基対間の 2 本の DNA 鎖間の結合を担っています。アデニンとチミンはそれらの間に 2 つの水素結合を形成し、シトシンとグアニンは 3 つの水素結合を形成します。これらの結合は、DNA を二重らせん構造に保ちます。さらに、これらの結合は DNA の複製にとって重要です。結合の強さが鎖を一緒に保つためですが、ある程度の力で壊れるほど弱いため、複製の際に鎖を分離することができます。
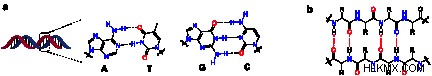
これらの結合は、DNA と多くのタンパク質が最適な pH と温度を持つ理由でもあります。 pH が低い場合、これは H イオンの濃度が高いことを意味します。これらのイオンは反応性があるため、水素結合を切断し、電気陰性原子に結合することで置換できます。 pH が高い場合、つまり OH イオンの濃度が高い場合にも同じことが起こります。負の酸素は水素に引き付けられ、結合が壊れ、水酸化物中の酸素と DNA 塩基対中の水素との間に新しい結合が形成される可能性があります。 pH の詳細については、こちらをご覧ください。
これらの結合は、温度によっても切断される可能性があります。システムが加熱されると、分子はより速く動き始め、水素結合を切断するのに十分なエネルギーを獲得します。これらの結合は DNA や多くのタンパク質の構造に不可欠であるため、生体系に有害な変化をもたらす可能性があります。
薬物における水素結合
水素結合は、薬物の組成と体内での相互作用を考える際に不可欠です。具体的には、薬物が特定の標的分子に作用している場合、その機能を変化させるために何らかの方法で分子に結合する必要があります。この結合が発生するためには、薬物が分子上の活性部位にしっかりと結合できるようにするため、水素結合が不可欠です。これは酵素と基質の相互作用にも見られ、水素結合が緊密でありながら可逆的な結合を可能にします。
水素結合と沸点
前述のように、水素結合は最も強い分子間力です。その結果、物質の圧力または温度が上昇すると、これらの結合に問題が生じます。これらの結合は強力であるため、これらの結合を切断するには、ファン デル ワールス力または双極子間力を切断するよりも多くのエネルギーが必要です。
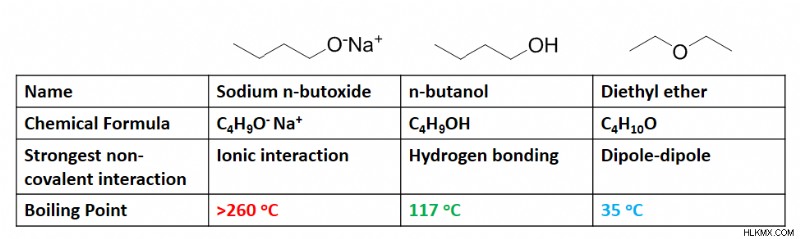
たとえば、この表は、化合物に水素結合が存在する場合に発生する沸点の劇的な変化を示しています。この場合、分子の構造がわずかに変化するだけで沸点が 3 倍になり、これらの結合の導入が可能になります。上記のように共有結合やイオン結合よりも弱いですが、その強度によって安定性が増し、沸点が劇的に変化することは明らかです。
さらに読む
- 表面張力と蒸気圧
- 比熱とは?
- 正式な請求
- ギブの自由エネルギーとは?







