電子軌道とは?
電子軌道 特定の電子が存在する原子核の周りの 3 次元領域です。各軌道は 2 つの電子を保持できます。それらは原子軌道としても知られています。原子軌道は、原子が持つ電子の数に応じて、さまざまな形になります。 s軌道、p軌道、d軌道、f軌道について学びます。また、それらの軌道形状も学習します。
正確な定義 軌道の、確率に基づいて、原子内の電子の位置を記述する数学関数です。 「原子軌道」は一般に、その軌道の数学関数に基づいて、電子が存在する可能性がある空間の領域を指します。
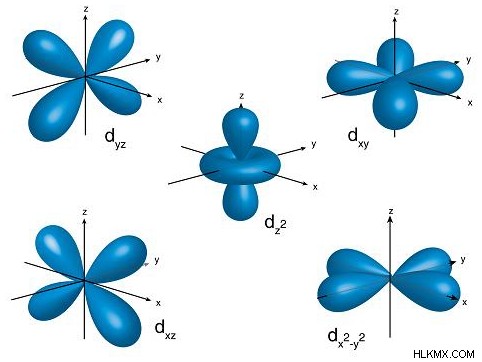
縮退軌道は、方向が異なる同じ主エネルギー準位と副準位にある軌道です。たとえば、3D 平面上の d 軌道の 5 つの向きは縮退軌道です。
量子数の基本的な復習
量子数の詳細については、量子数の記事をご覧ください。軌道のエネルギー準位、形状、向き、電子スピンを示す 4 つの量子数があります。
<オール>角運動量量子数と軌道形状
角運動量量子数は、0 から (n -1)。したがって、主量子数 (n ) =4、角運動量量子数は 0、1、2、および 3 です。
各角運動量量子数は、軌道の特定の形状に対応する文字を表します。このように、主量子数が大きいほど角運動量量子数が大きくなり、軌道形状が複雑になります。ほとんどの場合、s 軌道、p 軌道、d 軌道、および f 軌道を知る必要があるだけです。f 軌道の後では、形状が複雑になりすぎます。
| 主量子 # (n ) | 角運動量量子 # (l ) | 手紙 | 軌道形状図 |
| 1 | 0 | s | 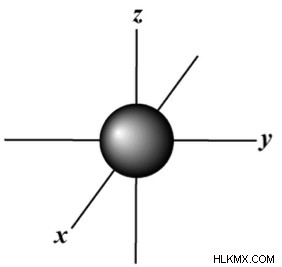 |
| 2 | 1 | p | 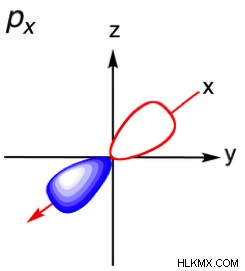 |
| 3 | 2 | d | 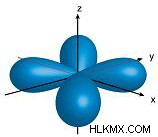 |
| 4 | 3 | f |  |
電子はどのように軌道空間を占めるのですか?
S軌道
n =1 の場合、最初のメイン エネルギー レベルでは、可能な唯一のサブレベルまたは軌道は、球形をした s 軌道です。
P軌道
n =2 の場合、2 つのサブレベルが可能です。これらは s 軌道と p 軌道です。覚えていると思いますが、磁気量子数は軌道の向きを示し、値は –l +l .そのため、s 軌道には 1 である磁気量子数が 1 つしかありません。つまり、可能な向きは 1 つだけです。球はどのように回転させても同じ形状であるため、これは理にかなっています。したがって、p 軌道には 3 つの可能な方向 (-1、0、1 の磁気量子数) があります。
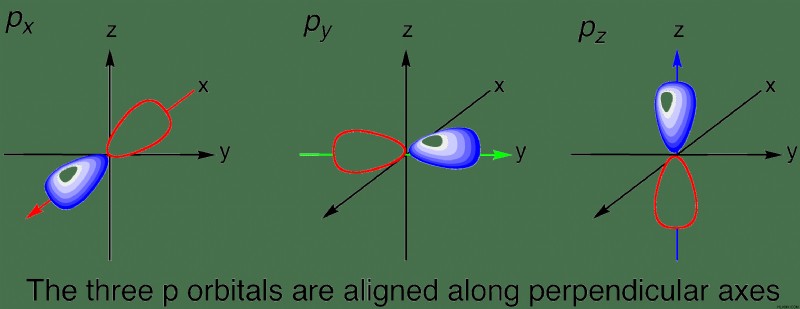
メインの第 2 エネルギー準位の最後の要素であるネオンには、10 個の電子があります。これらの電子はどのように分布し、配置されていますか?最初の 2 個の電子は、1s 軌道、または最初の主エネルギー準位の s 軌道に入ります。次に、次の 2 つの電子が 2s 軌道、または 2 番目の主なエネルギー準位の s 軌道を占めます。 s 軌道の向きは 1 つしかないため、エネルギー準位ごとに s 軌道は 1 つしかないことに注意してください。最後に、最後の 6 個の電子が 2p 軌道に均等に分割されます。 p 軌道には 3 つの向きがあるため、エネルギー レベルごとに 3 つの p 軌道があります。
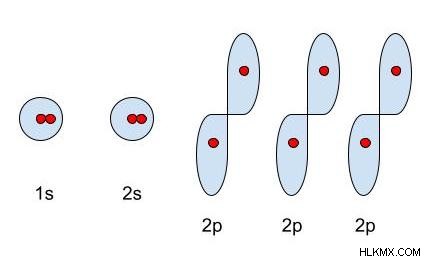
上記の例に示すように、電子は、それらが存在する軌道によって識別できます。電子配置は、電子が原子の軌道にどのように編成されているかを示します。
詳細
他の関連記事もチェックしてください!
- 電子親和力とは?
- 価電子とは?
- アウフバウ原則







