次亜塩素酸は、水素、酸素、塩素を含む弱酸です。次亜塩素酸はpKa=7.5の弱酸ですが、強力な酸化剤です。食細胞による病原体の殺傷作用を担っています。
HOCl とは?
次亜塩素酸は弱酸です。その化学式はHOClです。
別名: また、以下を含むいくつかの他の名前もあります:
- 水酸化塩素
- 次亜塩素酸水素
- 次亜塩素酸
- ヒドロキシドクロリン (IUPAC 名)
- 塩素 (I) 酸
- 水酸化塩素
- クロラノール
これはしばしば塩素のオキシ酸と呼ばれます。
発見: フランスの化学者、アントワーヌ バラードは、1834 年に次亜塩素酸を発見しました。その一価塩素は、酸化剤または還元剤として機能します。それは人間の代謝産物として機能します。次亜塩素酸は不安定な酸です。次亜塩素酸塩の共役酸で、活性酸素ファミリーに属します。
次亜塩素酸の式と構造
次亜塩素酸の式は、HOCl または HClO です。次亜塩素酸のルイス構造は次のとおりです。
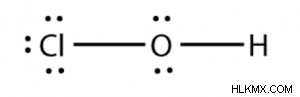
次亜塩素酸のルイス構造
したがって、上記の構造から、次のように結論付けることができます:
- 2 つの共有結合ペアがあります。
- 孤立電子対が 5 つあります。
- HOCl には 10 個の非結合電子があります。
次の図に示すように、HOCl の形状は曲がっています。
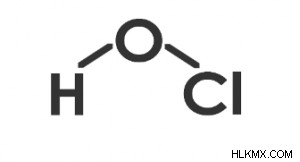
HOClの構造
化合物中の水素原子の存在は、それが酸であることを示唆しています。脱プロトン化される傾向があります。つまり、水素イオンを失います。
HOCl-次亜塩素酸の性質
次亜塩素酸のpKa値は比較的高いです。 7.53です。酸解離定数のこの負の対数基数 10 は、より低い酸解離を示唆しています。したがって、HOCl が弱酸であることを証明します。この酸は部分的にその構成イオンに解離し、その能力が弱いことがその弱い性質の理由です。
HOCl酸は室温で無色の液体です。その塩素は穏やかで、すぐに消えます。極性分子です。原子と孤立電子対の電気陰性度の違いにより、不均一な電荷分布が生じます。この非対称分布により、極性が生じます。次亜塩素酸の味は正確にはわかっておらず、純粋な形は不安定です。次亜塩素酸は主に水中の水溶液として存在します。
HOCl酸はオキソ酸、すなわち酸素原子を含む酸です。 HOCl 酸の重要な特性の概要は次のとおりです。
- モル質量または分子量:52.457 g/mol
- モノアイソトピック質量:51.972 g/mol
- いいえ。水素結合受容体:1
- 水素結合ドナー:1
- 物理的状態:液体
- 色:無色
- 溶解度:水溶性
- におい:刺激性、塩素のようなもの
- 酸の強さ:弱い
- 酸度 pKa:7.53
- 腐食性:腐食性
- 毒性:有毒
- 極性:極性
- 形状:曲がった
次亜塩素酸の分子量の計算
次亜塩素酸のモル質量または分子量を計算するには、その構成原子の原子質量を知る必要があります:
塩素 =35.5
水素 =1
酸素 =16
したがって、HOCl の分子量は次のように計算できます。
=水素 + 酸素 + 塩素の分子量
=1 + 16 + 35.5
=52.5 g/mol
したがって、HOCl の分子量は 52.5 g/mol です。
次亜塩素酸の使用
前述したように、次亜塩素酸の主な用途は消毒剤です。ただし、その用途は細菌を殺すことに限定されません。酸は、さまざまな業界でさまざまな用途があります。次のリストは、HOCl 酸の主な用途をまとめたものです:
- デオドラントなどのいくつかの消費財の成分です。
- 人間を含む哺乳動物の白血球に自然に見られます。
- 海水が HOCl に変換される海洋衛生装置。
- アルケンをクロロヒドリンに変換する際に使用されます。
- HOCl はベビー用品などの化粧品にも使用されています。
- スイミング プールに追加されます。
- 安全な消毒剤の製造
- 創傷ケアの目的で広く使用されています。
- 人間とペットの複数の感染症の治療用
- HOCl は、肌をクレンジングし、落ち着かせ、落ち着かせることが証明されています。次亜塩素酸スプレーは、有害物質への暴露による赤みやその他の有害な変化を治療するためによく使用されます.
- 次亜塩素酸ナトリウムは、歯科の根管に使用されます。
皮膚への次亜塩素酸の使用
HOClは人体に存在します。細菌、感染症、および一般的な病気に対する防御のために白血球によって製造されます。
侵入する病原体を攻撃し、抗菌酸として機能します。人間の皮膚は丈夫で耐久性があり、外側の保護バリアとして機能します。この最前線の防御により、多くの場合、皮膚は切り傷、ほこり、擦り傷などに対して脆弱になります. HOCl は
によってあなたの肌に追加のバックアップを提供します- 毛穴の詰まりやニキビの原因となるバクテリアと戦います。
- ダメージの修復と傷の治癒を早める。
- 湿疹や乾癬などの炎症や皮膚の問題と闘う.
このように、次亜塩素酸スプレーは、有害な細菌を除去するために毎日の皮膚メンテナンスルーチンに組み込まれています.ただし、敏感肌の方は、香料入りの HOCl スプレーを使用しないでください。
HOCl 酸の生成
次亜塩素酸は、塩素(Cl
Cl2 + H2 O ⇌ HClO + HCl
次亜塩素酸の生成により、塩化水素 HCl の水溶液も生成されることに注意する必要があります。
化学反応
以下は、HOCl 酸のいくつかの重要な化学反応です。
解離
次亜塩素酸は、水溶液中で部分的に次亜塩素酸アニオン ClO に解離します。解離反応を以下に示します:
HClO ⇌ ClO + H
この次亜塩素酸イオンは、さまざまな塩を形成します。一般的な次亜塩素酸塩 - 次亜塩素酸ナトリウム (NaClO) は漂白剤の成分です。
酸化
重要な特性で述べたように、次亜塩素酸は強力な酸化剤です。標準条件下では、塩素よりも強力な酸化剤です。
2 HClO(aq) + 2 H+ + 2 e− ⇌ Cl2(g) + 2 H2 O
HCl との反応
塩酸や塩酸と反応して塩素ガスを発生します。化学反応は次のとおりです:
HClO + HCl → H2 O + Cl2
アンモニアとの反応
アンモニアと反応してクロラミンと水を生成します。バランスの取れた反応は次のとおりです。
NH3 + HClO → NH2 Cl + H2 O
脂質との反応
次亜塩素酸は脂質と特異的に反応します。不飽和脂質結合とのみ反応し、飽和結合とは反応しません。次亜塩素酸イオンまたはClOは反応に関与しません。
この反応には、加水分解と、炭素原子への塩素の付加、および他の炭素原子へのヒドロキシルの付加が含まれます。このプロセスは、クロロヒドリンの形成につながります。 RBC の脂質二重層におけるクロロヒドリン形成は、その透過性を高めます。そのため、より多くのクロロヒドリンが形成されると、混乱が生じる可能性があります.
次亜塩素酸は安全に使用できますか?
EPA (米国環境保護庁) は、次亜塩素酸を無害と見なしています。
ただし、それは酸化剤であり、その pH と濃度によっては腐食性になる可能性があります。次亜塩素酸水の目や皮膚への刺激をテストするために、いくつかの臨床試験が実施されています。 HOCl水は無毒であり、皮膚や目に刺激を与えないと結論付けられました.
2017 年の研究では、生理食塩水を純粋な次亜塩素酸で保存すると、まぶたの細菌種の多様性を変えることなく細菌負荷が減少したことが確認されました。 20 分間の治療後、細菌は 99% 減少しました。
さらに、次亜塩素酸は非常に不安定で、活性化合物は容易に塩水に戻ります。したがって、その消毒能力は容易に失われます。この特性により、HOCl は輸送が困難になります。また、その高いコストにより、アルコールや漂白剤と比較して消毒剤としての使用はあまり一般的ではありません.技術の進歩により、次亜塩素酸水の製造コストは、家庭用および業務用で大幅に削減されました。ただし、賞味期限が短いのが気になるところです。
結論
次亜塩素酸は非常に有用な弱酸です。塩素、酸素、水素が含まれています。曲がった構造をしており、不安定な化合物です。抗菌特性で有名な HOCl は、酸であるにもかかわらず、局所適用しても安全です。それは活性創傷ケア剤であり、そのスプレーは皮膚の問題の治療にも使用されます.
よくある質問
Q1. HOClの水性塩に酸を加えるとどうなりますか?
A. 漂白剤溶液中の次亜塩素酸ナトリウムのような次亜塩素酸の水性塩に添加すると、反応は左に押し出されます。その結果、塩素ガスが発生します。塩素ガスは、水酸化ナトリウムのような単純な水溶液に溶解します。したがって、固体の次亜塩素酸塩漂白剤が形成されます。
Q2. HOCl酸はどのようにアミノ酸と反応しますか?
A. 次亜塩素酸とアミノ酸は、後者が側鎖を持っているため、容易に反応します。次亜塩素酸塩素はアミノ酸の水素を置換し、有機クロラミンを形成します。ただし、塩素化アミノ酸は、より長く持続するタンパク質クロラミンとは対照的に、迅速に分解されます.
Q3. HOClの中心原子が塩素ではなく酸素なのはなぜですか?
A. 構造は通常、電気陰性度が最も低い原子を決定することによって構築されます。次に、電気陰性度が最も低い原子が中心に配置されます。 HOCl では、酸素の電気陰性度は 3.44 です。塩素は3.16です。水素の電気陰性度は 2.2 です。したがって、水素は電気陰性度が最も低い原子です。ただし、単結合しか形成できないため、中心原子になることはできません。塩素は電気陰性度が最小という点で次に来る。それでも、中心の塩素が構造を妨害するため、酸素は水素に直接結合する必要があるため、中心原子になることはできません.したがって、電気陰性度が最も高くても、中心原子は酸素です。