アンモニアは、その窒素原子が陽子を容易に受け入れる電子対を持っているため、弱塩基です。また、アンモニアは水に溶けると、水から水素イオンを受け取り、水酸化物イオンとアンモニウムイオンを生成します。アンモニアに特徴的な塩基性を与えるのは、これらの水酸化物イオンの生成です。
いくつかの化合物は、それらがどれほど著しく臭いであるかで特によく知られています.高校時代、化学実験室の前を通りかかったとき、ときどき刺激的な「腐った卵」のにおいがしたことを覚えています。 「彼らは硫化水素を扱っているに違いない」と私たちはよく言っていました。私たちがすぐに認識した別の化合物はアンモニアでした。その強烈で浸透する匂いは、多くの場合、尿、洗浄剤、人間の汗に関連しています。
この記事では、アンモニアとその性質、およびアンモニアが酸か塩基かについて説明します。
それでは、上から見てみましょう…
アンモニアとは?
アンモニアは、1 つの窒素原子と 3 つの水素原子を含む化合物です。 あざねとも呼ばれます (その IUPAC 名)、その化学式は NH3 です。
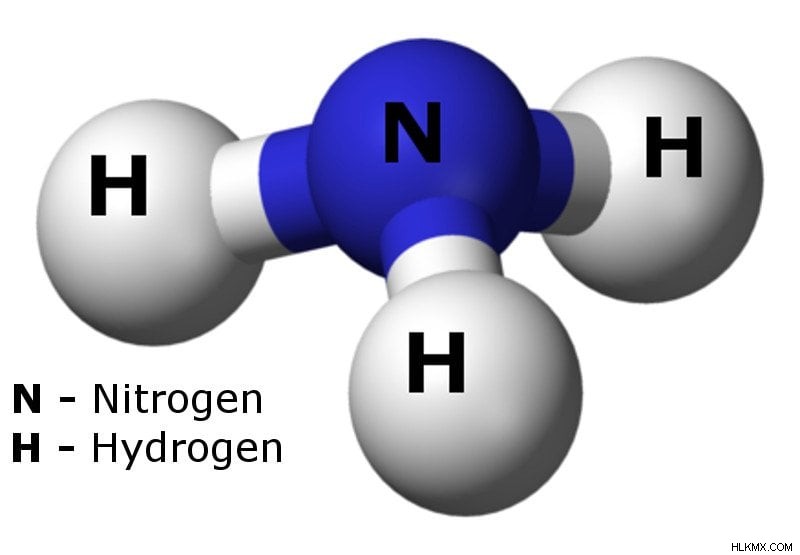
アンモニアの球棒モデル (写真提供:Ben Mills / Wikimedia Commons)
尿、クリーニング製品 (多くの製品には非常に少量のアンモニアが含まれているため)、時には人間の汗に似た鋭い刺激臭のおかげで、簡単に認識できます。
ただし、酢酸または炭酸水素ナトリウムと反応させると、無臭のアンモニウム塩が生成されるため、浸透する臭いは除去できます。
アンモニアの性質
アンモニアは無色の気体で、自然界にごく少量しか存在しません。その密度は空気の 0.589 倍で、空気よりも軽いことを意味します。水によく溶けるので、一般的に「アンモニア水」と呼ばれる水溶液として使用されます。アンモニアは、窒素を含む植物や動物から生成され、雨水にも微量含まれています。
アンモニアは、木星 (0.026%) や土星 (0.012%) などのガス惑星の大気にも存在します。

木星の表面に見える上部のアンモニア雲は、赤道に平行な帯状に配置されています。 (写真提供:ESA/ハッブル/ウィキメディア・コモンズ)
弱塩基とは?
弱塩基は、水溶液 (溶媒が水である溶液) 中で部分的にしか解離しない化合物です。別の言い方をすれば、弱塩基は水溶液中で完全にイオン化しないということです。初心者にとって、イオン化とは、原子または分子が電子を獲得/喪失してイオンを形成し、負/正の電荷を獲得するプロセスです。
弱塩基のより技術的な定義が必要な場合は、プロトン化が不完全な塩基です。弱塩基の例としては、メチルアミン、アラニン、そしてもちろんアンモニアがあります.
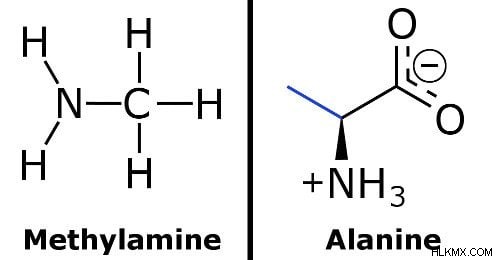
(写真提供:Nothingserious &Abbey311 / ウィキメディア コモンズ)
アンモニアが弱塩基になる理由
アンモニアは、下図の化学構造から弱塩基と見なされます。
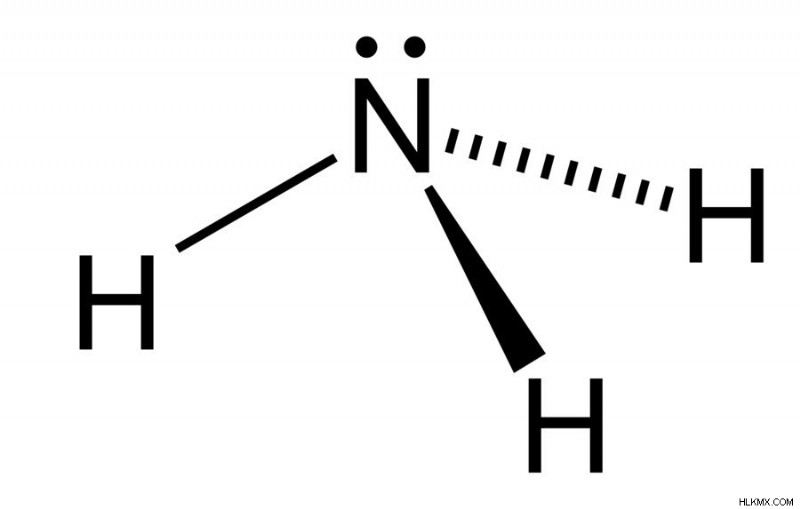
窒素原子の孤立電子対に注目してください (写真提供者:Ben Mills / Wikimedia Commons)
窒素原子上の電子の配置に注目してください。これは孤立電子対 (結合に直接関与していない電子) で構成されており、プロトンを供与するのではなく容易に受け入れるため、アンモニウム イオンが形成されます。
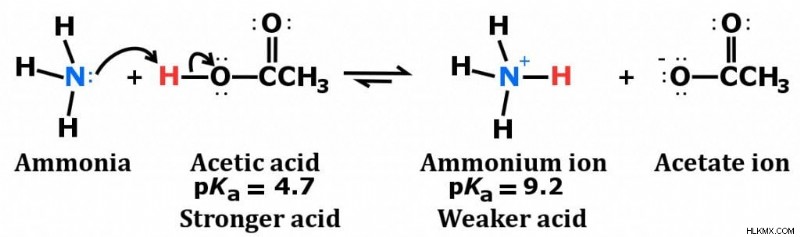
また、前述のように、NH3 分子の極性と水素結合を形成する能力のおかげで、アンモニアは水によく溶けます。水に溶解すると、アンモニアは水から水素イオンを獲得して、水酸化物イオンとアンモニウム イオンを生成します。
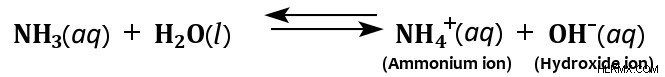
アンモニアの特徴的な塩基性を付与するのは、これらの水酸化物イオンの生成です。ただし、溶解したアンモニアのすべてが水と反応してアンモニウムイオンを生成するわけではなく、これがアンモニアを弱塩基にします.
さらに、アンモニウム イオンは水中で分解してアンモニアと水素イオンを生成するため、水溶液中で弱酸として作用します。
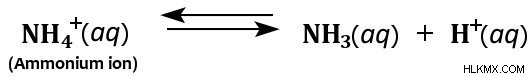
したがって、アンモニアは主に弱塩基と見なされますが、水溶液中では弱酸としても作用します。