コア コンセプト
このチュートリアルでは、イオン半径の傾向について紹介します 元素の周期表で。また、イオン半径を見つける方法など、イオン半径に寄与する概念についても紹介します。
他の記事で取り上げるトピック
- 周期表の金属と非金属
- 原子半径の傾向
- 電子配置の書き方
- 価電子とは
- 格子エネルギーとは
語彙
- 原子半径 – 化学元素の原子半径は、その原子のサイズの尺度であり、通常は核の中心から最も外側の孤立した電子までの平均または典型的な距離です。
- イオン半径 – は、イオン結晶構造における単原子イオンの半径です。原子もイオンも明確な境界を持っていませんが、陽イオンと陰イオンのイオン半径の合計が結晶格子内のイオン間の距離を与えるような半径を持つ硬い球であるかのように扱われます。
- 価電子 – 原子の最外殻またはエネルギー準位にある電子。
イオンとは?
イオンは、正または負の電荷を運ぶ原子です。周期表の原子が電子を失うと、陽イオンになります。対照的に、周期表の原子が電子を獲得すると、陰イオンになります。
周期表のほとんどの金属は陽イオンを形成する傾向があります。たとえば、グループ 1A (アルカリ金属) の金属はすべて +1 の電荷を持っており、電子を放出したいという意味です。非金属は陰イオンになる傾向があります。
イオン半径
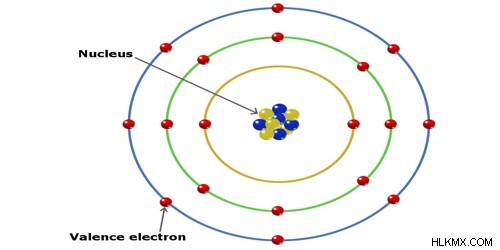
定義により、イオン半径は、イオンの核から電子の最も外側の殻 (原子価殻) までの距離です。したがって、下の図では、核内の黄色と青色の陽子間の距離を測定することで、イオン半径が求められます。最外軌道の赤い電子へ。これは半径がどのように測定されるかを視覚化したものですが、軌道の境界が非常に曖昧であるため、これが正確である可能性は低いです。
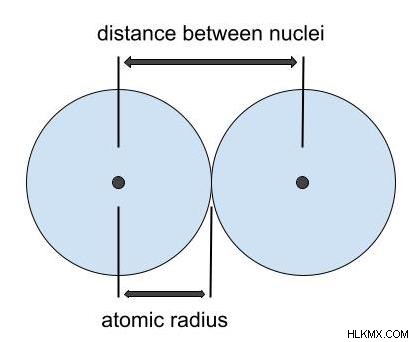
イオンのイオン半径は、原子が結晶格子構造にあるときに測定されます。イオン半径は、互いにちょうど接触している 2 つのイオン間の距離の半分です。前述のように、電子殻の殻境界は読みにくいです。そのため、原子のイオンは球であるかのように扱われます。イオン半径は、元素の中性原子が持つ半径である原子半径よりもわずかに小さいか大きい場合があります。
イオン半径を見つける
イオンは結合に存在する傾向があるため、イオン半径は 2 つの原子間のイオン結合を介して求めることができます。さらに、イオン半径は、イオンが存在する環境のさまざまな要因に依存するため、測定が困難です。それは、中心原子またはイオンが錯体または配位化合物で最も近い隣人として保持する原子、イオン、または分子の数に依存します。また、イオンのスピン状態にも依存します。イオン半径は、一般に、2 つの原子核間の距離を推定し、それを原子サイズで割ることによって計算されます。イオン半径は通常、ピコメートル (pm) またはナノメートル (nm) で測定されます。
陽イオン対。陰イオン
陽イオンは原子価殻から電子を失うため、親の中性原子よりもイオン半径が小さいことがよくあります。陰イオンの逆は、陰イオンが最外殻に電子を獲得するため、通常、親の中性原子よりも大きな半径を持ちます.
例 .ナトリウム (Na) の原子半径は 190 pm ですが、ナトリウム (Na) のイオン半径はわずか 116 pm です。
例 .塩素原子 (Cl) の原子半径は 79 pm、塩素イオン (Cl) のイオン半径は 167 pm です。
周期表におけるイオン半径の傾向
イオン半径とグループ
周期表を下に移動すると、追加の電子が追加され、イオン半径が増加します。
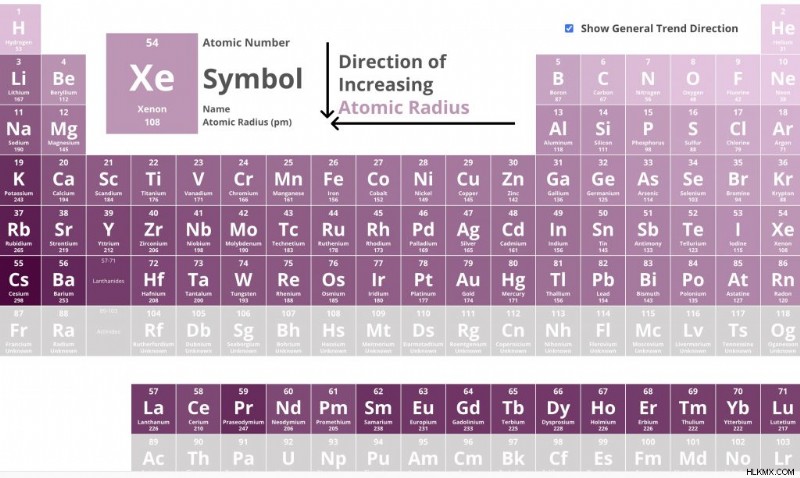
周期表のグループ 2 を見てください (アルカリ土類金属)
- ベリリウムのイオン半径 – 午後 31 時
- マグネシウムイオン半径 – 午後65時
- カルシウムイオン半径 – 午後 99 時
- ストロンチウムのイオン半径 – 午後 113 時
- バリウムのイオン半径 – 午後135時
周期表を下に移動するにつれて原子半径が増加する傾向と一致します。
イオン半径と周期
周期表を移動すると、より多くの電子、陽子、および中性子が追加されます。したがって、半径を大きくすることは理にかなっていますが、そうではありません。これは、周期表の行を移動すると、陽イオンを形成する金属のイオン半径が減少するためです。有効核電荷が減少すると、非金属のイオン半径が増加します。
カリウム (K) から周期表を移動
- カリウム (K) イオン半径 – 午後137時
- カルシウムイオン (Ca) 半径 – 午後 99 時
- スカンジウムイオン (Sc) 半径 – 午後87時
周期表で右に移動するにつれて、イオン半径のサイズが減少していることに注意してください。