コア コンセプト
このチュートリアルでは、脱退グループとは何かを学びます 良いものを識別する方法と同様です。さらに、さまざまな有機化学反応で見られる脱離基の例のリストを学習します。
他の記事で取り上げるトピック
- 求核剤
- 求電子剤
- 陽イオンと陰イオン
- 酸と塩基の性質
- pKaとは
- 共鳴
- 縮合反応
語彙
- 陰イオン- 負に帯電したイオン
- 塩基性- 分子が塩基としてどのように機能するか
- カチオン- 正電荷を帯びたイオン
- 共役塩基- 酸がその酸性水素を失うときに形成される分子
- レゾナンス- 電子は分子内の隣接する場所に移動して、異なる電荷位置を作成します
グループ定義からの脱退
脱離基とは、孤立電子対を持つ分子から離れて、分子と分子の間の結合を切断できる原子または原子団です。求核試薬の反対として機能します。電子を供与して共有結合を形成する代わりに、その結合を切断し、離れるときに電子を受け取ります。このため、主な分子は通常、電子を失ったままになり、陽イオンになります.
脱離基は通常、陰イオンまたは中性ですが、陽イオンの場合もあります。
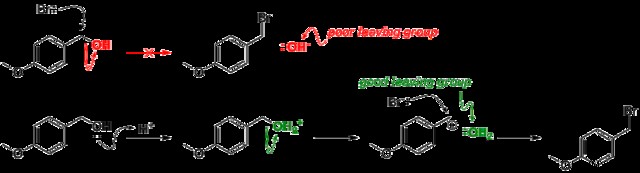
よい脱退グループとは?
原子または原子群がそれ自体でより安定しているほど、脱離基は優れています。
弱いベース
良い脱離基は、強酸、弱塩基の共役塩基です。孤立電子対との共役塩基が安定であるほど、塩基は弱くなります。 pKa は、孤立電子対の安定性の測定値として使用できます。 pKaが低いほど、酸が強くなり、共役塩基が弱くなります。詳細はこちら
サイズと塩基性
周期表の右下に移動すると、サイズが大きくなります。サイズと塩基度には反比例の関係があり、サイズが大きくなると塩基度が低下します。したがって、脱離基のサイズが大きいほど、塩基として弱くなり、分子から離れやすくなります。
レゾナンス
共鳴は分子の安定性に大きな役割を果たします。それは、分子内の電子の移動によって電荷が再配置または中和される場合です。弱い塩基は通常、単独で使用できるほど安定した共鳴構造を持っています。そのため、脱離基を共鳴安定化できる場合、主分子から容易に脱離する可能性が高くなります。
集団脱退
- ハロゲン - Br、I、Cl
- スルホン酸塩 - OT、OM
- アンモニア - NH3
- 水 - H2 ああ
さらに読む
- E1 リアクション
- E2 リアクション
- Sn1 反応
- Sn2 反応