パウリ除外原則の定義
パウリの排他原理は、どの原子においても、電子は別の電子と同じ 4 つの電子量子数を持つことはできないと述べています。すべての電子は、異なる量子数を持っている必要があります。したがって、各電子軌道 (同じ n 、l、 そしてml ) 2 つの電子が存在する可能性があり、それらは異なるスピンを持っている必要があります。 1 つの電子は ms になります =+ ½ およびその他の m =– ½。したがって、2 つの電子が同じ 4 つの量子数を持つことはありません。
スピン量子数 (ms ) が、以前に発見された 3 つの量子数 (n) に追加されました。 、l 、ml ) パウリの排他原理によって。正の ms 通常、スピンアップを示し、上向きの矢印で表されます。負の ms 通常、スピンダウンを示し、下向きの矢印で表されます。スピン量子数は、他の量子数に依存しないため、他の量子数とはわずかに異なります。 + ½ または – ½ の値のみを持つことができ、これらの値は他のすべての量子数から独立しています。他の量子数はすべて相互接続されています。

この原理は、各軌道が 2 つの電子しか持つことができないことも定義しています。この定義は、最初の 3 つの量子数によって定義される軌道に由来します。残りの量子スピン数には 2 つの可能な値しかありません。したがって、パウリの排他原理の定義によれば、軌道は 2 つの電子しか保持できません。
フェルミオン対ボソン
この原則はすべてのフェルミオンに適用されます。フェルミオンは半整数スピンを持つ原子粒子です。一般的に知られているフェルミ粒子は、電子、陽子、および中性子です。したがって、これらの粒子はすべてパウリの排他原理に従います。
フェルミオンの代替はボソンです。ボソンには整数のスピンがあります。最も一般的なボソンは光子です。 1 つのエネルギー状態に多くの光子が存在する可能性があります。ある状態では、それらはすべて同じ量子数を持っています。これはパウリの除外規則に違反しています。ただし、光子はボソンであるため、パウリの排他規則には従いません。
化学におけるパウリ排除原理の応用
パウリの排他原理は、原子の電子殻構造を決定する際に重要です。アウフバウの原理と組み合わせて、どの電子軌道が満たされるかを知ることができます。パウリの排他原理を使用すると、軌道に 2 つの電子がある場合、1 つが上向きスピン (+ ½ ) で、もう 1 つが下向きスピン (- ½ ) でなければ、異なる量子数を与えられないことがわかります。ただし、軌道に電子が 1 つしかない場合、正または負のスピンを持つことができます。
パウリの排他原理の発見は、周期表のいくつかの現象と、いくつかの原子がどのように結合するかの背後にある理由を説明するのにも役立ちました.特に固体の場合、これまで説明されていなかった多くの特性が、パウリの排他原理を使用して説明できました。
問題例
ヘリウム
最も単純な原子はヘリウムです。ヘリウムは 1s 軌道に 2 つの電子を持っています。 1s 軌道には量子数 n があります =1、l =0、および ml =0。両方の電子がこのサブシェルに入ります。したがって、1 つの電子には量子数があります n =1、l =0, ml =0、および ms =+1/2。もう一方の電子は量子数 n を持ちます =1、l =0, ml =0、および ms =-1/2.

ベリリウム
ベリリウムには、1s 軌道と 2s 軌道を満たす 4 つの電子があります。以下は、パウリの排除原理と正しい描写に違反する電子配置の例です。
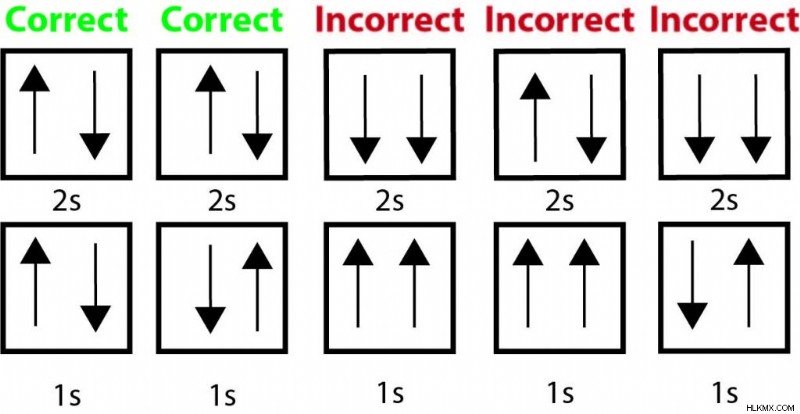
すべての間違ったオプションには、同じ軌道で同じ方向を指す (同じスピンを示す) 矢印があります。これは、それらが同じ 4 つの量子数を持ち、パウリの排他原理に違反していることを示しています。
次に、各電子の量子数を一覧表示して、同じ 4 つの量子数を持つ電子がないことを確認することもできます。
1s シェルを埋めることから始めます。つまり、主量子数 n は 1 です。また、s 軌道は l の値 0 で示されます。 .
- 電子 1:n =1、l =0, ml =0、および ms =– ½
- エレクトロン 2:n =1、l =0, ml =0、および ms =+ ½
これで 1 のシェルが満たされます。次のシェルは 2s で、主量子数 n を変更します 2.
- エレクトロン 3:n =2、l =0, ml =0、および ms =– ½
- エレクトロン 4:n =2、l =0, ml =0、および ms =+ ½
4 つの電子すべての量子数を比較すると、どれも同じではありません。結論として、彼らはパウリの排除原則に従っています。
パウリ排除原則の歴史
パウリの排他原理は、1925 年にヴォルフガング パウリによって発見されました。この原理は、ボーア モデルを拡張したものです。この原理が最初に発見されたとき、彼はそれを電子だけに適用しました。その後、この原理は 1940 年にパウリによってすべてのフェルミオンに拡張されました。
ヴォルフガング パウリは、量子化学における発見と研究により、1945 年にノーベル物理学賞を受賞しました。彼はゼーマン効果の説明にも取り組み、ニュートリノの存在を提唱しました。パウリは 1900 年にオーストリアで生まれ、1958 年に亡くなりました。