主な違い - 酸化と還元
酸化と還元は、酸化還元反応の 2 つの半反応です。酸化還元反応は、原子間の電子交換によって起こる化学反応です。酸化と還元の主な違いは、酸化は原子の酸化状態の増加であるのに対し、還元は原子の酸化状態の減少です。
対象となる主な分野
1.酸化とは
– 定義、メカニズム、例
2.リダクションとは
– 定義、メカニズム、例
3.酸化と還元の違いは何ですか
– 主な違いの比較
重要な用語:酸化、酸化状態、酸化剤、レドックス反応、還元剤、還元 
酸化とは
酸化は、原子、分子、またはイオンからの電子の損失として定義できます。この電子の損失により、化学種の酸化状態が増加します。酸化反応は電子を放出するので、電子受容種が存在するはずです。したがって、酸化反応は主反応の半分の反応です。化学種の酸化は、その酸化状態の変化として与えられます。 酸化状態 特定の原子、分子、またはイオンによる電子の損失または獲得を示す、正 (+) または負 (-) 記号の数字です。
以前は、酸化という用語には「化合物への酸素の付加」という定義が与えられていました。これは当時、酸素が唯一の酸化剤であったためです。しかし、この定義はもはや正確ではありません。なぜなら、酸素の不在下で起こる酸化反応はもっと多いからです。例えば、マグネシウム(Mg)と塩酸(HCl)の反応は酸素を含まず、MgからMgへの酸化を含む酸化還元反応です。次の例は、レドックス反応における酸化および還元反応を示しています。
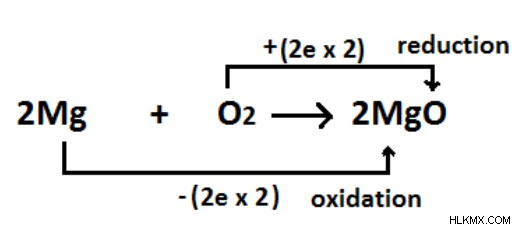
図 01:Mg への酸素の添加による Mg の酸化。 Mg から 2 つの電子が放出され、1 つの酸素原子が 2 つの電子を取得します。
別の歴史的定義があります 水素を含む酸化用。つまり、酸化は H イオンを失うプロセスです . H イオンの放出なしで起こる反応が多いため、これも正確ではありません。
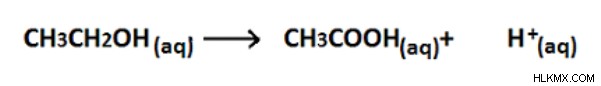
図 02:アルコール基のカルボン酸基への酸化
酸化は常に、電子の損失により化学種の酸化状態を増加させます。この電子の損失により、原子または分子の電荷が変化します。
酸化メカニズム
酸化は、酸化状態の変化に応じて、4 つの異なる方法で発生します。
1.ゼロから正の酸化状態へ
電荷を持たない (中性) 分子または原子は酸化される可能性があります。酸化は常に酸化状態を増加させます。したがって、原子の新しい酸化状態は正の値になります。
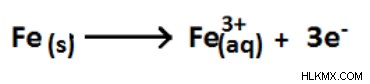
図 03:Fe (0) から Fe (+3) への酸化
2.マイナスからプラスの酸化状態へ
負の酸化状態にある原子は、正の酸化状態に酸化される可能性があります。
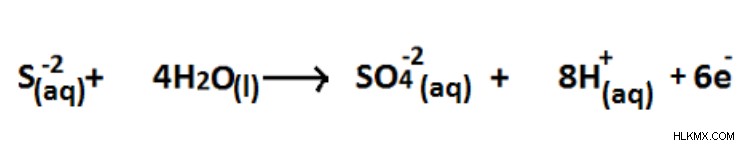
図 04:S (-2) から S (+6) 酸化状態への酸化
3.マイナスからゼロ酸化状態へ
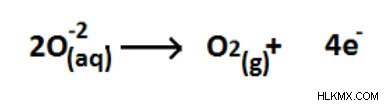
図 05:O (-2) から O2 (0) への酸化
4.正の酸化状態の増加
このタイプの酸化反応は主に遷移金属元素に含まれます。これらの金属元素は複数の酸化状態を保持でき、d 軌道の存在により最大 +7 の酸化状態を示すからです。 .
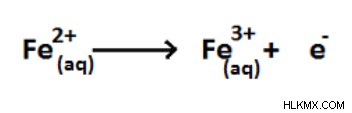
図 06:Fe (+2) から Fe (+3) への酸化
中性原子は、原子核内の陽子 (正電荷) と原子核の周りの電子 (負電荷) で構成されています。原子核の正電荷は、電子の負電荷と釣り合っています。しかし、電子がこの系から取り除かれると、対応する正電荷を中和する負電荷がなくなります。すると、原子は正電荷を帯びます。したがって、酸化は常に原子の正の特性を高めます。
削減とは
還元は、原子、分子、またはイオンからの電子の獲得として定義できます。この電子の獲得により、化学種の酸化状態が減少します。これは、還元によって原子に余分な負の電荷が生じるためです。外部から電子を得るためには、電子供与種が存在する必要があります。したがって、還元は酸化還元反応中に起こる化学反応です。還元反応は半反応です。
縮小メカニズム
縮小は、次の 4 つの方法でも発生します。
1.ゼロからマイナス酸化状態へ
たとえば、酸化物の形成では、O2 の酸化状態 はゼロで、新しい電子の追加により -2 に減少します。
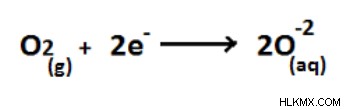
図 07:酸素の還元
2.正から負の酸化状態へ
正の酸化状態と負の酸化状態を保持できる元素は、このタイプの還元反応を受けることができます。
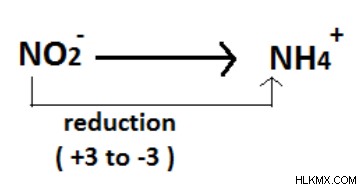
図 08:N (+3) から N (-3) への削減
3.正の酸化状態からゼロの酸化状態へ
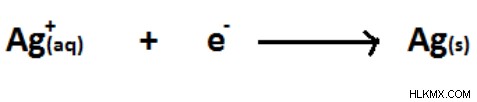
図 09:Ag+ の減少
4.マイナス酸化状態の減少
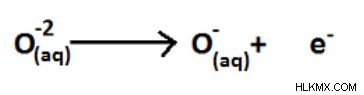
図 10:O (-2) から O (-1) への削減
一般に、化合物中の酸素原子の酸化状態は -2 です。しかし、過酸化物では、互いに結合した 2 つの酸素原子があります。両方の原子は同じ電気陰性度を持っています。したがって、両方の原子の酸化状態は -2 になります。次に、1 つの酸素原子は -1 の酸化状態を持ちます。
酸化と還元の違い
定義
酸化: 酸化は、原子、分子、またはイオンからの電子の損失として定義できます。
削減: 還元は、原子、分子、またはイオンからの電子の獲得として定義できます。
酸化状態の変化
酸化: 酸化状態は酸化で増加します。
削減: 酸化状態は還元で減少します。
電子の交換
酸化: 酸化反応により、周囲に電子が放出されます。
削減: 還元反応は、周囲から電子を取得します。
電荷の変化
酸化: 酸化は、化学種の正電荷の増加を引き起こします。
削減: 還元は、化学種の負電荷の増加を引き起こします。
関与する化学種
酸化: 酸化は還元剤で起こります。
削減: 還元は酸化剤で起こります。
結論
酸化と還元は、酸化還元反応の 2 つの半反応です。酸化と還元の主な違いは、酸化は原子の酸化状態の増加であるのに対し、還元は原子の酸化状態の減少であることです.