共有結合物質には、極性分子と非極性分子の両方が見られます。共有結合分子の中には分極する能力があるものと、そうでないものがあります。極性分子と非極性分子は、さまざまな方法で相互作用します。極性分子は双極子間相互作用などの力によって互いに相互作用しますが、非極性分子はロンドン分散力によって互いに相互作用します。これらの分子が本質的にどのように互いに異なり、どのように相互作用するかを見てみましょう.
この記事では、
1.極性分子とは?
– 定義、特徴、および例
2.非極性分子とは
– 定義、特徴、および例
3.極性分子と非極性分子はどのように相互作用しますか?
極性分子とは
極性分子は、分子内に電子が非対称に分散した結果です。共有結合は、2 つの原子間で 2 つの電子を共有することによって形成されます。これらの原子は、同じ元素の場合もあれば、2 つの異なる元素の場合もあります。 2 つの異なる元素が含まれている場合、電気陰性度 (電子を引き付ける能力) が似ている場合もあれば、電気陰性度が異なる場合もあります。 2 つの原子間の電気陰性度の差が 0.4<である場合、より電気陰性度の高い原子が共有電子対を自分自身に向かって引き寄せる大きな傾向があります。したがって、わずかに負の電荷 (δ-) が誘導され、他の原子はわずかに正 (δ+) のままになります。このプロセスは分極化と呼ばれます .
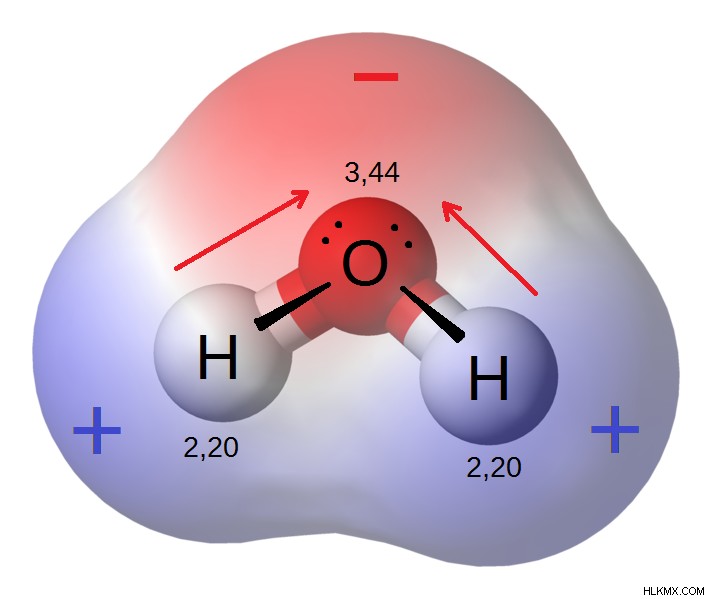
図 1:水分子の永久双極子
水分子は極性分子の良い例です。 O と H の電気陰性度の差は 1.5 です。したがって、共有された電子のペアは、電気陰性度の高い酸素原子の方に引き付けられます。したがって、水分子は分極していると言われています。
極性分子の他の例としては、アンモニア (NH3 )、硫化水素 (H2 S) および二酸化硫黄 (SO2 ).
非極性分子とは
非極性分子は電子が対称的に分布しています。したがって、電荷分離はありません。基本的に、これは電気陰性度が似ている 2 つの原子が一緒になって共有結合を作るときに起こります。したがって、それらが共有する電子のペアは、関与する原子のいずれにもほとんど偏っていません。このような分子では電荷分離は見られません。ただし、電荷分離があっても、一部の分子の形状によって電荷が相殺されます。 CO2 は典型的な例です。

図 2:二酸化炭素のルイス構造
C 原子と O 原子の間に極性結合の資格を得るのに十分な電気陰性度の差がありますが、分子の線形形状により電荷が相殺され、正味の双極子が生じます。ゼロの。したがって、二酸化炭素分子は非極性分子と見なされます。
非極性化合物の例は、主に N2 などの二原子ガス分子です。 、Cl2 そしてO2 .炭化水素液体は、ほとんどの場合無極性でもあります。トルエン、ガソリン、ペンタン、ヘキサンなどがその例です。
極性分子と非極性分子はどのように相互作用するのか
2 種類の分子は、互いに異なる方法で相互作用します。
極性分子はどのように相互作用するのか

図 3:2 つの HCl 分子間の双極子間相互作用
極性分子は、双極子間相互作用などの力によって互いに相互作用します。極性分子は、非対称電子分散のために不均一な電荷分布を持つことが以前に議論されました。したがって、ある極性分子のわずかに正の端は、別の分子のわずかに負の端に向かって引き付けられます。上の図 (3) は、相互作用を明確に示しています。
1 つの分子のわずかに正の H 原子は、2 番目の分子のわずかに負の Cl 原子に向かって引き付けられます。 2 つの分子間の引力は、双極子間相互作用として知られています。
水素結合と呼ばれる特殊な双極子間相互作用があります .この相互作用には、分子の電気陰性度の高い原子である水素供与体が関与します。これは、その水素を供与して、別の分子からの孤立電子対を持つ別の電気陰性度の高い原子と結合を形成します。後者は水素受容体と呼ばれます。次の図 (4) は、水中の水素結合を示しています。
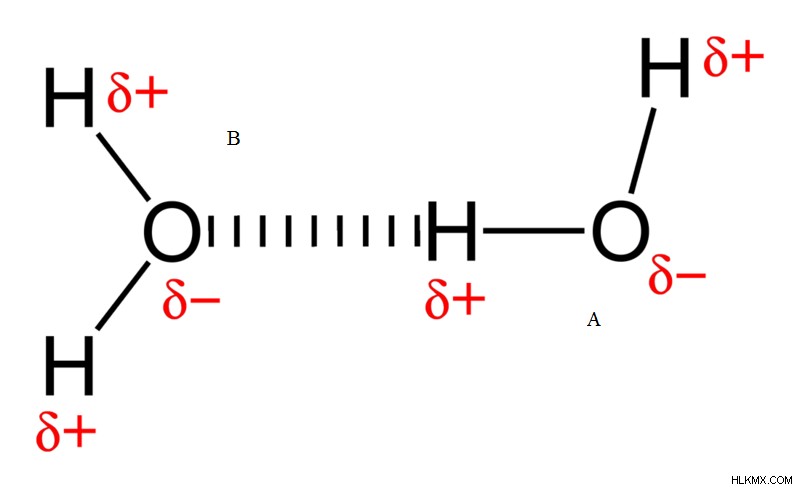
図 4:水中の水素結合
B とラベル付けされた酸素原子は、酸素原子 A から水素を受け取り、2 つの水分子の間に結合を形成します。酸素原子 A は水素供与体であり、酸素原子 B は水素受容体です。
非極性分子はどのように相互作用するのか
無極性分子は双極子間相互作用を形成できません。代わりに、それらはロンドン分散力を形成することによって相互に作用します。
分子の電子はランダムに動きます。電子が非極性分子の一方の端に向かって収集されると、その特定の端にわずかな負電荷が誘導されます。分子のもう一方の端をわずかに正にします。これにより、分子上で一時的な電荷分離が発生します。別の非極性分子が近くに来ると、前者の分子は後者にも双極子を誘導する能力を持っています。これは、同種の電荷が反発するために発生します。 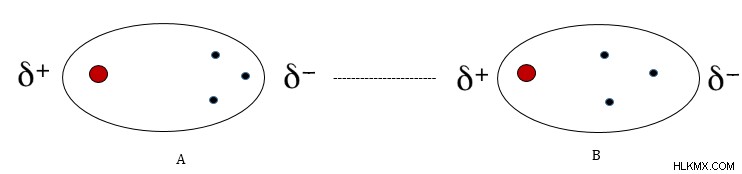
分子 A の負の末端の電子密度は、分子 B の隣接する末端の電子を反発し、その末端に正電荷を誘導します。次に、両端の間に弱い結合が形成されます。
極性分子と非極性分子間の相互作用
ロンドン分散は、極性分子の双極子間力よりもはるかに弱いと呼ばれます。したがって、極性分子が非極性分子と相互作用する傾向は最小限です。極性分子と非極性分子の間の分散力の形成によって放出されるエネルギーは、極性分子間の強い双極子間相互作用を壊すのに十分ではないためです。したがって、非極性溶質は極性溶媒に溶解できません。
カータス、ロン。 「極性分子と非極性分子」。 化学を理解する:チャンピオンのための学校 . N.p.、n.d.ウェブ。 2017 年 2 月 7 日.「極性化合物と非極性化合物が互いに溶解しないのはなぜですか?」 化学スタック交換 . N.p.、n.d.ウェブ。 2017 年 2 月 7 日。