主な違い – ソリューションと停止
溶液と懸濁液はどちらも混合物と見なされます。 主な違い 溶液と懸濁液の間の粒子サイズです。 溶液中の粒子は、懸濁液の粒子よりもはるかに小さいです。 溶質粒子と懸濁液粒子のこの違いにより、2 つのシステムには明確な違いがあります。ただし、両方のシステムのコンポーネントは互いに化学的に結合されておらず、サイズ、溶解度、密度などの物理的特性に基づいて分離できます。
この記事では、
1.ソリューションとは
– 定義、特徴、例
2.停止とは?
– 定義、特徴、例
3.ソリューションとサスペンションの違いは何ですか? 
ソリューションとは – 定義、特徴、例
溶液は、2 つの物質の均一な混合物です。システムの最も豊富な成分は溶媒として知られていますが、溶質は溶液に溶解している物質です。溶質粒子は、原子レベルまたは分子レベルのいずれかです。溶質粒子のサイズは通常 <1 nm です。溶媒と溶質は同じ相にあり、光学顕微鏡でも区別できません。溶液の均質性は、溶質が溶媒中に均等に分布しているという事実から生じます。溶液系の成分は、懸濁液やコロイドよりも分離が比較的困難です。
例:NaCl は白い固体です。水に溶かすと白い固形物が見えなくなります。代わりに、透過的なソリューションのみが表示されます。
溶質粒子のサイズが小さいため、溶液は透明になり、光の反射や散乱が防止されます。溶液は、所定の温度で安定しており、粒子が沈降することなく均一なままです。
溶液の形成は、溶媒に対する溶質の親和性に依存します。極性溶質は極性溶媒にのみ溶解し、非極性溶質は非極性溶媒にのみ溶解します。水は最もよく知られている極性溶媒です。塩、砂糖、KCl などの極性溶質は容易に溶解します。ベンゼン、ヘキサン、石油エーテルなどのほとんどの有機溶媒は無極性です。非極性溶媒の例として、ヨウ素と発泡スチロールが挙げられます。
解決策の例を次に示します。
ガス中のガス:空気
液体中のガス:ソーダ
液体中の液体:水とアルコール
液体中の固体:水中の NaCl
固体中の液体:水銀アマルガム、銀中の水銀
固体中の固体:合金、鋼、真鍮、青銅
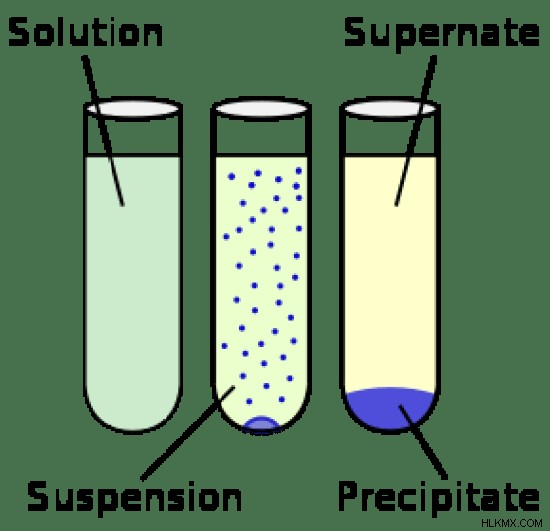
サスペンションとは - 定義、特徴、例
懸濁液の粒子は、多くの場合 1000 nm を超えます。したがって、サスペンションは不均一です。それらは一段階のものではありません。土が水と混ざると、大きな土の粒子がはっきりと見え、水と区別できます。このシステムは典型的なサスペンションです。懸濁液中の粒子は、媒体を通って移動し、時間とともに沈降する傾向があります。粒子のサイズが大きいため、ろ過によって簡単に分離できます。粒子サイズが大きいため、溶液とは異なり、懸濁液は濁っています。光はこれらの粒子によって散乱または反射されます。
最も知られている懸濁液は、固体粒子を液体に懸濁させることによって形成されます (例:泥水、CaCO3 水中で)。ただし、液体 - 液体懸濁液 (油/水中の水銀)、固体 - 気体懸濁液 (空気中のすす) が発生する可能性があります。エマルジョンは、混じり合わない2つの液体が一緒に振られて濁った混合物を形成する懸濁液の形態です。これを放置すると、2つの液層の分離が容易に見られます。油と水の組み合わせは、エマルジョンの良い例です。
経口薬の中には、懸濁液として入手できるものがあります。たとえば、制酸剤治療に使用されるマグネシアのミルクは、水酸化マグネシウムの懸濁液です。
一時停止は一段階ではありません。システムをしばらく放置すると、相分離が発生する可能性があります。したがって、これらは安定していません。

ソリューションとサスペンションの違い
構成
解決策: ソリューションは均一です(組成は全体で同じです)。溶質粒子は溶媒に溶解し、均一に分散します。
一時停止: 懸濁液は不均一です。粒子は視覚的に区別でき、粒子の分散は均一ではありません。
粒子サイズ
解決策: 粒子サイズは<1 nmです。それらは比較的非常に小さく、原子または分子レベルのいずれかです。光学顕微鏡でも見ることができません。
停止: 粒子サイズは>1000 nmです。粒子は比較的大きく、肉眼で見ることができます。それらは凝固として存在する可能性があります。
プロパティ
解決策: 溶質と溶媒は同相です。
停止: 浮遊粒子は、媒体とは異なる相にある可能性があります。
外観
解決策: ソリューションは透過的です。光の散乱はありません。
停止: サスペンションは曇っています。光は反射または散乱します。
例
解決策: 例としては、水中の NaCl や水中の砂糖などがあります。
停止: 例には、マグネシアのミルク、空気中のすすが含まれます。
参照リスト:
「物事の溶解度:化学に関するウェブサイト。」 溶質、溶媒、溶液の定義と例 .オンライン教育、n.d.ウェブ。 2017 年 2 月 1 日。「混合物、溶液および懸濁液」。 エンジニアリング ツールボックス . N.p.、n.d.ウェブ。 2017 年 2 月 1 日。Rezabal、Elixabete、Thomas Schäfer。 「極性および非極性溶質の溶媒としてのイオン液体:親和性と配位。」 物理化学化学物理 17.22 (2015):14588-14597.「コロイド溶液」。 増幅 . N.p.、n.d.ウェブ。 2017 年 2 月 1 日。懸濁液の性質。」 化学 . Byjus クラス、2016 年 11 月 8 日。ウェブ。 2017 年 2 月 1 日。Shukla、Brajesh。 「サスペンションとは何ですか?その特性について教えてください。」 PreserveArticles.com . N.p.、n.d.ウェブ。 2017 年 2 月 1 日、ヴォランド、ウォルト。 「溶液、コロイド、および懸濁液。」 溶液、コロイド、懸濁液 . N.p.、2005 年 3 月 29 日。ウェブ。 2017 年 2 月 1 日。






